Kemi
Stofmængde af tavlekridt.
Hvad er stofmængden af 1g tavlekridt(ren CaCO3)?
Svar #1
01. oktober 2015 af Mawias
Slå op i din kemi eller fysik bog (muligvis i det periodiske system) og find det tal som står lige over hvert enkelt grundstof. Det tal angiver mol/g. Det skal du så finde for hvert enkelt af de atomer CaCO3 består af. Altså Calcium, Carbon og Oxygen. Og husk at der er tre oxygen atomer.
~ Mathias
Svar #2
01. oktober 2015 af 656
Jo tak.
Er det så sådan her man gør: 1/(40,08+12,01+3*16)=0,0099mol=9,9mmol ?
Svar #3
01. oktober 2015 af Mawias
Jeg kan ikke forstår hvor du gør det sådan her
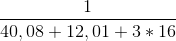
Du skal ikke lave det til en brøk, eller dividere dem. Hvad du nu enten tænke, men bare lægge dem sammen.
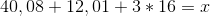
Det ville være dit svar. Man kunne selvfølgelig også sætte endnu flere decimal tal på, for at gøre det mere præcist.
Svar #6
01. oktober 2015 af 656
Fordi at jeg har lært at stofmængde beregnes sådan: n=m/M. Stofmængden betegnes oftest n og har enheden mol. Den kan beregnes for et fast stof ud fra massen m (angivet i gram, g) og molarmassen M (angivet i g/mol)
Svar #7
01. oktober 2015 af Mawias
Det er korrekt.
n=stofmængde
m=masse
M=Molarmassen
Du har to af de overstående. Stofmængden, og molarmassen, og du skal finde masse.
n=m/M
Du skal have isoleret m. Dette gøres ved at først gange M på begge sider. Så får du dette.
M*n=m
Den skal du bruge til at finde massen.
Svar #8
01. oktober 2015 af Mawias
Hvis du bare skal have stofmængden, skal du bare kigge på det periodiske system.
Svar #10
01. oktober 2015 af 656
Hvis jeg regner massen ud i unit ved at kigge på det periodiske system får jeg så ikke molarmassen?
Skriv et svar til: Stofmængde af tavlekridt.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




