Kemi
Termodynamik, Gibbs lov
02. februar 2016 af
Malene121
-
Niveau: A-niveau
Fremstilling af dihydrogen sker ved at lede vanddamp hen over glødende trækul. Herved dannes dihydrogen og carbondioxid
H2O(g) + C(s) –> H2(g) + CO (g)
a. Beregn ?G° ved 25 °C
b. Beregn den laveste temperatur, ved hvilken reaktionen vil have tilbøjelighed til at forløbe spontant, når alle gasser har partialtrykket 1bar
ER VIRKELIG LOST
Skriv et svar til: Termodynamik, Gibbs lov
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







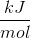
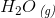
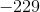
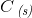
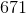
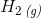
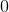
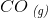
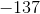
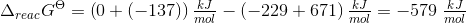
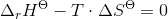
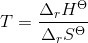
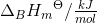
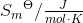
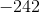
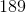
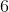
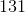
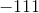
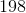
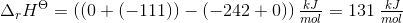
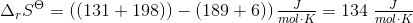
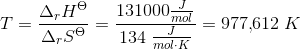
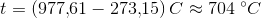
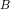 - for bildung = dannelses-
- for bildung = dannelses-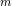 = pr mol/molære
= pr mol/molære