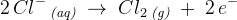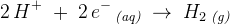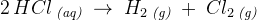Kemi
Elektrolyse af HCl
Hej alle
Vi har et forsøg om elektrolyse af saltsyre, og vi har virkelig brug for hjælp!
Vi er klar over, at hydrogen-ionerne går til minuspolen, da de er positive. Vi ved også, at hydrogen modtager en elektron, da den mangler 1 elektron for at blive stabil ifølge dublet-reglen.
Vi er også klar over, at hydrogen-ionerne går sammen 2 og 2 og derved bliver til H2.
Vi ved, at clor-ionerne går til pluspolen, da de er negative og derved tiltrækker plus. Clor-ionerne afgiver en elektron, da de har et overskud af elektroner, som man også kan se ved, at det hedder Cl-.
Det vi er i tvivl om er, hvorfor at clor afgiver en elektron, når den har 7 elektroner i sin yderste skal og derved kun mangler en elektron for at blive stabil ifølge oktet-reglen. Det undrer os, at den ikke optager en elektron og derved opnår 8 i sin yderste skal frem for at afgive en elektron.
Skriv et svar til: Elektrolyse af HCl
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





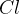 -atomer men
-atomer men 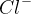 -ioner, som har 8 elektroner i M-skallen. For at danne
-ioner, som har 8 elektroner i M-skallen. For at danne 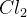 sammenholdt af et fælles elektronpar, skal
sammenholdt af et fælles elektronpar, skal