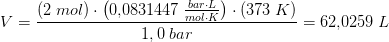Kemi
Idealgasloven
Jeg har fået følgende opgave: opskriv idealgasloven og brug denne til at beregne Volumen af 2 mol O2 med et tryk på 1,0 bar ved en temperatur på 100 grader celsius.
Jeg ved at idealgasloven = P*V= n*R
er denne udregning korrekt:
V=2mol*0,08 L bar/ mol K *373 K / 1,0 bar
V= 59,68 L
Svar #1
13. juli 2016 af Eksperimentalfysikeren
Jeg har ikke slået værirdien af R efter, men med forbehold for det ser det eksemplarisk korrekt ud.
Skriv et svar til: Idealgasloven
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.