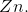Kemi
Astem reaktionsskemaet for redoxreaktionen
Efter at have set nogle læring videoer omkring OT og afstemning fa redoxreaktioner har jeg stadig lidt svært ved at afstemme en reaktionsskema.
Jeg har reaktionsskemaet:
Fe?2+ ?(aq) + NO3?- ?(aq) → Fe?3+ ?(aq) + NO(aq)
Jeg er igang med at finde oxidationstallene for grundstofferne. Er det rigtigt at Fe?2+ ? har OT= 2
NO-?3 ? har OT 5 ? jeg ved ikke helt om det er korrekt, og hvorfor det egentlig har det. Jeg har set en reaktion i bogen hvor stoffet indgår, og derfra har jeg OT , 5, hvis i vil forklarer mig hvorfor vil det hjælpe supermeget.
OT for fe?3?+? er 3
OT for NO er 0.
Jeg ved jeg skal bruge romertal, men jeg ved ikke lige hvordan jeg kan anvende dem her. Jeg skal vist nok finde stigningen og fald i oxidationstal nu??? men er de de OT jeg har korrekt. Kan i evt hjælpe mig videre.
Svar #1
26. juli 2016 af Skaljeglavedinelektier
Fra Gyldendal: Ved fastlæggelse af OT benyttes, at OT er nul for atomer i et grundstof, og at summen af OT for en formelenhed er lig med formelenhedens ladning. I forbindelser er OT for hydrogenatomer (H) og oxygenatomer (O) normalt hhv. +1 og −2, mens natrium (Na) og fluor (F) altid har OT hhv. +1 og −1. Betragtes fx HNO3(salpetersyre), er OT +1 for H, −2 for O og dermed +5 for N (nitrogen).
Oxidationstal:
Fe har OT +2 eller +II (romertal) i Fe2+
Fe har OT +3 eller +III i Fe3+
N har OT +5 eller +V i NO3-
N har OT +2 eller +II i NO
Du finder så hvor meget Fe oxideres, og hvor meget N reduceres. Bruges til at afstemme mellem de to ved at gange på kryds. Bestem ladningen på hver side. Afstem med H+ eller OH- alt efter hvilket miljø det foregår i - det er nok surt så afstem med hydroner. Afstem med vand så der er lige mange hydrogen- og oxygenatomer på hver side.
Svar #3
26. juli 2016 af mathon
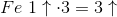
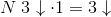
afstemning af op- og nedgange:
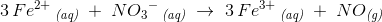
afstemning af ladning:
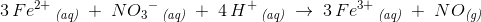
afstemning af hydrogen:
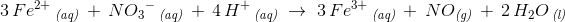
oxygen stemmer.
Svar #4
26. juli 2016 af HFNU (Slettet)
Jeg forstår godt at Hydrogen har OT + 1, og oxygen har OT-2 , men hvordan kan OT for NO-3? være + 5.
Det er jeg stadig ikke helt med på........
Svar #6
26. juli 2016 af HFNU (Slettet)
1000 tak mathon for du lige vil vise hvordan NO3?-? er lig med + 5.
Jeg vil lige spørger omkring Fe?2?+ har OT 2? og ligeledes hvorfor Fe?3+ ? har OT +3.
Er det fordi den Fe?2+ har afgivet 2 elektroner og dermed stiger OT 2? og det samme gælder for Fe?3+ so så har afgivet 3 elektroner og derfor stiger til OT 3.
Hvorfor har NO = OT 2
Svar #7
26. juli 2016 af mathon
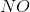 har ikke oxidationstrin
har ikke oxidationstrin  ;
;
men
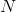 i
i 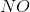 har oxidationsrin
har oxidationsrin 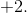
Ladning udadtil i 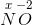 er
er 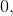
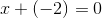
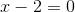
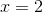
Svar #8
26. juli 2016 af HFNU (Slettet)
Tak det kan jeg godt se. Jeg forstår godt afstemningen, men jeg forstår desværre heller ikke hvorfor stigningen af : Fe er 3
og faldet er N er 3
Fra Fe2?+ til Fe?3+ ? er der en stigning på 1, men hvorfor skal man gange med 3?
Fra NO-??3 til NO sker der et fald på 1, og her ganges igen med 3?
Svar #9
26. juli 2016 af mathon
Fordi antallet opgange i oxidationstrin skal være lig med antallet af nedgange i oxidationstrin,
hvilket er grundlaget for teorien om redoxreaktioner.
Svar #10
26. juli 2016 af HFNU (Slettet)
Jeg har læst antallet af de forskellige atomer i den afstemte reaktionsligning skal være afpasset således, at den samlede opgang i OT er lig med med den samlede nedgang i OT, som du jo allerede har forklaret.
Men nu spørger jeg nok lige lidt for meget, men hvorfor kan OT ikke være 1. Stigningen er 1 og faldet kan jo så være 1...? hvorfor er OT 3
Svar #11
27. juli 2016 af mathon
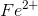 går ét oxidationstrin op
går ét oxidationstrin op
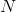 går 3 oxidationstrin ned
går 3 oxidationstrin ned
For at få lige mange op- og nedgange:
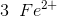 går 3 oxidationstrin op
går 3 oxidationstrin op
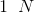 går 3 oxidationstrin ned
går 3 oxidationstrin ned
Antallet af op- og nedgange er altså identisk,
når der afstemmes med
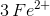 og
og 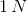
dvs med:
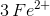 og
og 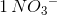
Svar #12
27. juli 2016 af HFNU (Slettet)
Ej mange tak igen mathon. Det er virkelig en god forklaring rigtig mange gange tak. For jeg forstår det virkelig nu, bortest fra det at jeg har et lille problem med
reaktanten NO??-3 ? . Er det ikke OT for N i NO-?3 som er 5.
Hvorfor regner man ikke OT for hele reaktanten? (NO-???3?)
Svar #13
27. juli 2016 af HFNU (Slettet)
Jeg spørger lige om 1 ting mere omkring ladningen. Hvordan har du lagt ladningens sammen i svar # 3.
Hvordan kan man regne ladningen på venstre side, og ligeledes på højre side og derefter sammenligne.
Svar #14
28. juli 2016 af HFNU (Slettet)
Er ladningen efter afstemning af H-atomer 7 på venstre og højre side?
Svar #15
28. juli 2016 af Skaljeglavedinelektier
Afstemning af ladning for reaktionen:
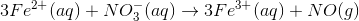
Du finder ladningen på reaktantsiden først: 3 * 2 - 1 = +5
Du finder ladningen på produktsiden: 3 * 3 = + 9
Ved at tilføre 4 hydroner på reaktantsiden er ladningen +9 på hver side.
Svar #16
29. juli 2016 af HFNU (Slettet)
3 Fe2+ ?(aq) + NO-??3 ?(aq) → 3Fe ?3+ ?(aq) + NO (g)
Er ladningen på venstre side +5 , fordi du siger 3Fe?2+ • NO-?3 ? 6 også trækker du 1 fra NO????- ?= 5
På højre side (produktsiden) er 3Fe?3??+ ?(aq) ?
Jeg kan nok ikke helt forstå hvordan ladningen er 9 på hver side endnu. Kan du fortælle hvilke tal du gange med hinanden.
Svar #17
29. juli 2016 af HFNU (Slettet)
Hvis jeg har reaktionen
Zn + SO2-??4 →? Zn2+ + H2?S
Har jeg så regnet OT rigtigt for disse stoffer:
OT for Zn : 0
OT for SO4?2??- :? 6
OT for Zn ?2+ ?: 2
OT for H?2?O : 2 ( fordi der er 2 Hydrogen atomer?)
Er det korrekt at stigningen er på 2
Faldet på 4?
Håber jeg kan få lidt hjælp til dette stykke også, for jeg er lige begyndt at lære omkring emnet. Mange mange tak
Svar #18
29. juli 2016 af mathon
#16
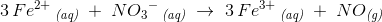

Der tilføres nu 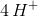 på venstre side
på venstre side
derefter er
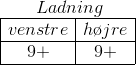
og
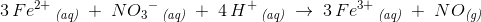
hvorefter du afstemmer hydrogen ...






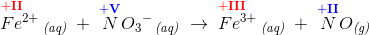
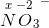
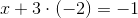
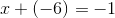
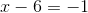
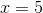
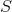 i
i 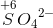 befinder sig i sit højst mulige oxidationstrin og derfor kke lader sig oxidere af
befinder sig i sit højst mulige oxidationstrin og derfor kke lader sig oxidere af