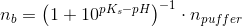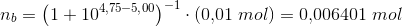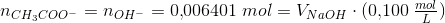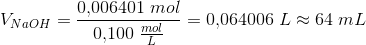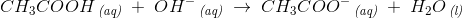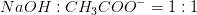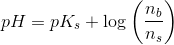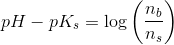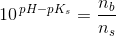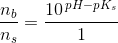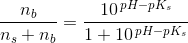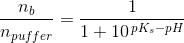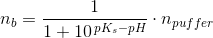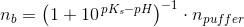Kemi
Kemisk ligevægt samt pH
17. september 2016 af
SophieSamantha (Slettet)
-
Niveau: A-niveau
Jeg kan ikke helt finde ud af hvordan jeg skal beregne denne her opgave .. jeg håber at der er nogle derude som kan hjælpe mig :)
Eddikesyre, CH3COOH, har en styrkekonstant på 1.76*10^-5. Hvor mange mL 0.100 M NaOH skal der tilsættes til 100 mL 0.100 M eddikesyre for at pH bliver 5.00?
Tak på forhånd!
Svar #2
21. september 2016 af Eliasz
Mathon, kan du ikke forklare hvordan du kommer til formlerne og hvorfor du netop siger at stofmængden af OH- er det sammen som stofmængden af CH3COO-??
Skriv et svar til: Kemisk ligevægt samt pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.