Kemi
Udfælding
NH4Cl(s) opløses uden rumfangsændring i en opløsning der er 0,050 M både mht MG2+ og NH3. Hvilken molaritet af NH4CL(s) skal mindst opnås for at forhindre udfælding af Mg(OH)2 ?
?Ksp for Mg(OH)2 = 8.9 * 10^-12
?Ka for NH4+ = 5.56 * 10^-8
Svar #1
21. maj 2017 af mathon
Hvilken molaritet af NH4Cl skal højst opnås for at forhindre udfælding af Mg(OH)2?
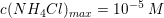
Svar #3
21. maj 2017 af Unintended96 (Slettet)
#1Hvilken molaritet af NH4Cl skal højst opnås for at forhindre udfælding af Mg(OH)2?
Mathon hvad skal du bruge dette til?
Svar #5
22. maj 2017 af mathon
med
![\small \left [ OH^- \right ]_{max}=10^{-5}\; M](https://media.studieportalen.dk/images/equations/XfdaxnUEtvfsq-apvDZ26Q==.gif)
haves ved 25°C
her kommer korrektionen:
![\small \left [ H_3O^+ \right ]_{min}=\frac{10^{-14}\;M^2}{10^{-5}\; M}=10^{-9}\;M](https://media.studieportalen.dk/images/equations/L7B7UysOFe_Z8iqTICs1dA==.gif)
hvor
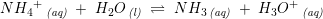
ækvivalentkonc. cs - α·cs α·cs α·cs
med ligevægtsbrøk:
![\small \frac{\left [ NH_3 \right ]\cdot \left [ H_3O^+ \right ]}{\left [ N{H_4}^+ \right ]}=K_s](https://media.studieportalen.dk/images/equations/nfDp-TCa7w-4jkGK7Ym-IA==.gif)
![\small \frac{ \left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}=5{,}6\cdot 10^{-10}\; M](https://media.studieportalen.dk/images/equations/pwW1uPmM7eBRrrGislMhcg==.gif)
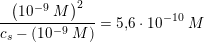
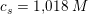
Koncentrationen af NH4Cl skal mindst være 1,018 M for at hindre udfældning af Mg(OH)2.
…
I beregningerne har jeg anvendt mine egne opslagsværdier for Ksp(Mg(OH)2) og Ks(NH4+).
Svar #7
23. maj 2017 af Rugberg420 (Slettet)
Fejlen i mathon's udledning er at der mangler at blive lagt 0,05 til concentrationen af NH3. Se vedhæftet billede.
https://www.dropbox.com/s/bs6d8j0jj6unp9v/December%2015%20spg%2024.PNG?dl=0
Held og lykke d. 30.
Skriv et svar til: Udfælding
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![\small \left [ Mg^{2+} \right ]=0{,}050\; M=5{,}0\cdot 10^{-2}\; M](https://media.studieportalen.dk/images/equations/qi-3UEvl7GkDROqlbnUkIw==.gif)
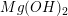 er
er 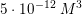
![\small \left [ Mg^{2+} \right ]\cdot \left [ OH^- \right ]^2=5\cdot 10^{-12}\; M^3](https://media.studieportalen.dk/images/equations/pQfuy7ZwmDoQm6mExwK6fg==.gif)
![\small \left [ OH^- \right ]=\sqrt{\frac{5\cdot 10^{-12}\; M^3}{\left [ Mg^{2+} \right ]}}](https://media.studieportalen.dk/images/equations/aBvTLrkP80RHeKiY7Xn0uw==.gif)
![\small \left [ OH^- \right ]=\sqrt{\frac{5\cdot 10^{-12}\; M^3}{5\cdot 10^{-2}\; M}}](https://media.studieportalen.dk/images/equations/-QHJXAMd-PsJowtUQtPWVw==.gif)
![\small \left [ OH^- \right ]=10^{-5}\;M](https://media.studieportalen.dk/images/equations/JCd82qB4BgsV_2DAGQkXjg==.gif)