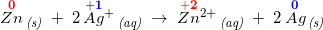Kemi
Redoxreaktioner
Jeg sidder og arbejder med opgave 129 i basis kemi c bogen. Jeg skal: Betragte følgende blandinger.
i delopgaven b, skal jeg angive Zink i en sølv(I)nitratopløsning.
Jeg ved at Zink=Zn og sølv=Ag.
Jeg ville skrive Zn(s) + Ag+ -> her går jeg så i stå. Jeg kiggede derefter på facit som er:
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s) , men jeg forstår overhovedet ikke hvorfor :(
Svar #1
11. juli 2017 af mathon
Zn er mindre elektronegativt end Ag+, hvorfor Ag+ ved kontakt trækker mere i Zn's yderste elektroner end resten af Zn-atomet gør,
hvoraf:
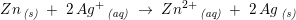
da Zn har to elektroner i yderste skal og Ag+ mangler én elektron i yderste skal.
Skriv et svar til: Redoxreaktioner
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.