Kemi
Hjælp til ligevægt
Hej
Jeg har lidt svært ved at regne nedenstående opgave.
Opskriv ligevægtsudtrykket for de to reaktioner. Hvad er enheden for de to Kc.
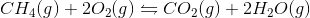
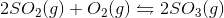
Mit forslag er
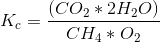
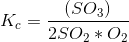
[K_{c}=\frac{(CO_{2}*(2H_{2}O)}{(CH_{4}*(O_{2})}]
[K_{c}=\frac{(SO_{3})}{2SO_{2}*O_{2}}] ?
Er det rigtigt?
På forhånd tak
Svar #3
07. august 2017 af annahansen2
#1 & #2. Jeg forstår intet af det du har skrevet hvad er RT og hvorfor kommer den liepludselig ind. Det er Kc
Som jeg skal beregne, så forstår jeg ikke hvad Kp er eller hvorfor den skal beregnes..
Håber, at der en der kan sætte ord på beregningerne, så det bliver lidt letforståeligt.
På forhånd tak
Svar #4
07. august 2017 af mathon
Når både reaktanter og produkter er gasser,
anvendes sædvanligvis ligevægtsbrøken
på formen:
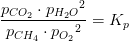
men for
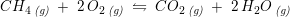
![\small \frac{[CO_2]\cdot {[H_2O]}^2}{[CH_4]\cdot {[O_2]}^2}=K_c](https://media.studieportalen.dk/images/equations/cJubyvpzAOo8xgW5x4ITYA==.gif)
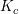 er uden enhed
er uden enhed
og for
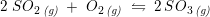
![\small \frac{\left [SO_3 \right ]^2}{\left [SO_2 \right ]^2\cdot \left [ O_2 \right ] }=K_c](https://media.studieportalen.dk/images/equations/PPclTc-me8AuEfkkBcErVA==.gif)
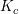 har enheden
har enheden 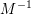
Svar #5
07. august 2017 af annahansen2
#4 Tak for forklaringen. Så man kan i virkeligheden godt nøjes med at skrive det op som du har gjort i #4 eller?
Svar #7
07. august 2017 af annahansen2
#6 er der en formel, som jeg kan bruge?
For mig virker det lettest hvis jeg har en formel og kan indsætte det jeg kender..
På forhånd tak.
Svar #8
07. august 2017 af annahansen2
Jeg synes at det virker så uoverskuligt for mig hvis jeg skal skrive det op som i #1 & #2. Derfor spurgte jeg om der var en formel således at man måske kunne nøjes med at skrive det op som i #4?
Svar #9
07. august 2017 af mathon
evt. brugbar formel:
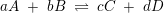
ligevægtsbrøk:
![\small \frac{ [C ]^c\cdot [ D ]^d}{ [ A ]^a\cdot [ B ]^b}=K_c](https://media.studieportalen.dk/images/equations/SAkj80D3TA-j2TrN9rnxiw==.gif) som kun har gyldighed for en homogen ligevægt.
som kun har gyldighed for en homogen ligevægt.
Svar #11
07. august 2017 af annahansen2
Jeg har forsøgt at løse nedenstående opgave nu vha. formlen i #9. Jeg håber at jeg har regnet det rigtigt.
Opgave: Opskriv udtrykket for ligevægtskonstanten. Kc = 50 ved 450 C.
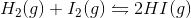
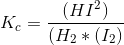
Har jeg løst denne opgave rigtigt?
På forhånd tak.
Svar #13
07. august 2017 af annahansen2
Jeg har et sidste spørgsmål og håber at der er nogle der kan hjælpe med om min beregning er rigtig.
I en beholder på 2,50L findes 1,76 mol hydrogen og 5,08 mol iod i ligevægt med hydrogeniodid ved 450 oC. Beregn stofmængden (mol) af HI i beholderen.
Stofmængden. 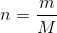

Er min beregning rigtig?
På forhånd tak
Svar #15
07. august 2017 af janhaa
#13Jeg har et sidste spørgsmål og håber at der er nogle der kan hjælpe med om min beregning er rigtig.
I en beholder på 2,50L findes 1,76 mol hydrogen og 5,08 mol iod i ligevægt med hydrogeniodid ved 450 oC. Beregn stofmængden (mol) af HI i beholderen.
Stofmængden.
Er min beregning rigtig?
På forhånd tak
disse er feil, se over
Svar #17
20. august 2017 af annahansen2
#4 Jeg har et spørgsmål til det du skriver i #4.
Spørgsmålet er, hvad er enheden for de to Kc?
I den første skriver du Kc er uden enhed og i den anden Kc har enheden M-1
Kan du forklare mig, hvad enhederne for de to reaktioner er, jeg forstår nemlig ikke det som du har skrevet.
På forhånd tak.
Skriv et svar til: Hjælp til ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




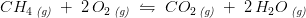
![\! \! \! \! \! \! \! \! \! \frac{p_{CO_2}\cdot {p_{H_2O}}^2}{p_{CH_4}\cdot {p_{O_2}}^2}=\mathbf{\color{Red} K_p}=\frac{\left [CO_2 \right ]\cdot RT\cdot \left (\left [ H_2O \right ]\cdot RT \right )^2}{\left [CH_4 \right ]\cdot RT\cdot \left (\left [ O_2 \right ]\cdot RT \right )^2}=\frac{\left [CO_2 \right ]\cdot \left [ H_2O \right ] ^2}{\left [CH_4 \right ]\cdot \left [ O_2 \right ] ^2}\cdot \left ( RT \right )^{1+2-(1+2) }=](https://media.studieportalen.dk/images/equations/---2cpEn2d7u3QfayH6XAg==.gif)
![\frac{\left [CO_2 \right ]\cdot \left [ H_2O \right ] ^2}{\left [CH_4 \right ]\cdot \left [ O_2 \right ] ^2}=\mathbf{\color{Red} K_c}](https://media.studieportalen.dk/images/equations/tqPNKWlTcXwFCWOt9jvYvA==.gif)
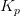 og
og 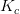 er dimensionsløse.
er dimensionsløse.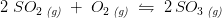
![\frac{{p_{SO_3}}^2}{{p_{SO_2}}^2\cdot {p_{O_2}}}=\mathbf{\color{Red} K_p}=\frac{\left (\left [SO_3 \right ]\cdot RT \right )^2}{\left (\left [SO_2 \right ]\cdot RT \right )^2\cdot \left [ O_2 \right ]\cdot RT }=\frac{\left [ SO_3 \right ] ^2}{\left [SO_2 \right ]^2\cdot \left [ O_2 \right ] }\cdot \left ( RT \right )^{2-(2+1) }=](https://media.studieportalen.dk/images/equations/DjEyaOQ3ZlDep1CHxKiKCw==.gif)
![\frac{\left [SO_3 \right ]^2}{\left [SO_2 \right ]^2\cdot \left [ O_2 \right ] }\cdot (RT)^{-1}=\frac{\mathbf{\color{Red} K_c}}{RT}](https://media.studieportalen.dk/images/equations/X1Bc3NNjjgjDYSN_taCtMg==.gif)
![\left [ K_p \right ]=Pa^{-1}](https://media.studieportalen.dk/images/equations/WWq1zdyAW2_NsPZCH-iQaA==.gif) evt.
evt. 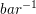
![\left [ K_c \right ]=M^{-1}](https://media.studieportalen.dk/images/equations/VaAIGniuXLJBseo-HnJa_A==.gif)
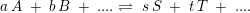
![\small \frac{[S]^s\cdot[T]^t\cdot .... }{[A]^a\cdot [B]^b\cdot ....}=K_c](https://media.studieportalen.dk/images/equations/wHNkDFQlChLa0tTpsDWwkQ==.gif)
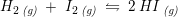
![\small K_c^{450^\circ}=\frac{[HI]^2}{[H_2]\cdot [I_2]}=50](https://media.studieportalen.dk/images/equations/45MCVX4sbqx-E_eiQu0Dow==.gif)
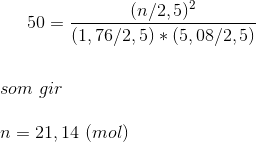
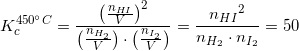
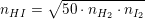
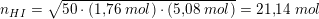
![[K_c]=M^3/M^3=M^0 =1](https://media.studieportalen.dk/images/equations/xjgQuFv_CWDODIVG4-X1tA==.gif)
![[K_c]=M^2/(M^2*M) =1/M = M^-1](https://media.studieportalen.dk/images/equations/YKITVfVijAaBCRvTAaR3zw==.gif)