Kemi
Aktuelle koncentrationer af ammoniumsulfat
a. Beregn den formelle koncentration af ammoniumsulfat i en opløsning af 0,023 mol ammoniumsulfat i en 250 mL opløsning.
Det har jeg fået til 0,092 M
b. Beregn de aktuelle koncentrationer af ammoniumioner og sulfationer.
Her er jeg lost. Jeg har googlet mig frem til at formlen for ammoniumsulfat er (NH4)2SO4
Hvordan beregner opgave b?
Svar #1
25. september 2017 af BadBoyBard (Slettet)
Bliver nu snart cand.polit., men kan nu godt huske mine gymnasie timer i kemi.
a) Du skal bruge formlen:
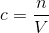
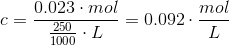
Så den er rigtig.
b) Prøv at skrive op, hvordan (NH4)2SO4 spaltes i en vandig opløsning.
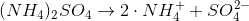
Du ved nu, at 0.023 mol ammoniumsulfat er i opløsningen. Stod der noget om, hvorvidt der skete en fuldstændig spaltning af ioner i din opgavebog?
Men hvis der sker en fuldstændig spaltning af ioner, så vil der være 0 mol (NH4)2SO4 tilbage. Men 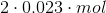 NH4+ og 0.023 mol SO4--.
NH4+ og 0.023 mol SO4--.
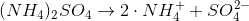
0 mol 2*0.023 mol 0.023 mol
Og opløsningen vil stadig være 250 mL. Kan du nu beregne koncentrationen?
Mvh
B
Skriv et svar til: Aktuelle koncentrationer af ammoniumsulfat
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




