Kemi
Koncentrationer og pH
Hej, kan nogen fortælle mig, hvordan man ville løse denne opgave?
"Den totale phosphatkoncentration i en serumprøve måles til 0,9 mM og pH til 7,21. Udregn koncentrationen af alle protolytiske former af phosphat ved dette pH."
Hertil er H2PO4-'s pKA selvfølgelig også 7,21, og bufferligningen skal sandsynligvis benyttes. Men hvordan udregnes denne?
Svar #1
05. august 2023 af Sveppalyf
Bufferligningen
pH = pKs + log(|B|/|S|)
Vi har i dette tilfælde:
7,21 = 2,12 + log(|H3PO4|/|H2PO4-|)
7,21 = 7,21 + log(|H2PO4-|/|HPO4--|)
7,21 = 12,67 + log(|HPO4--|/|PO4---|)
Dertil har vi at
|H3PO4| + |H2PO4-| + |HPO4--| + |PO4---| = 0,9*10-3 M
Dvs. fire ligninger med fire ubekendte.
Jeg får:
|H3PO4| = 2,69*10-4 M
|H2PO4-| = 2,19*10-9 M
|HPO4--| = 2,19*10-9 M
|PO4---| = 6,31*10-4 M
Svar #2
05. august 2023 af M2023
#0. Se venligst nedenstående diagram...
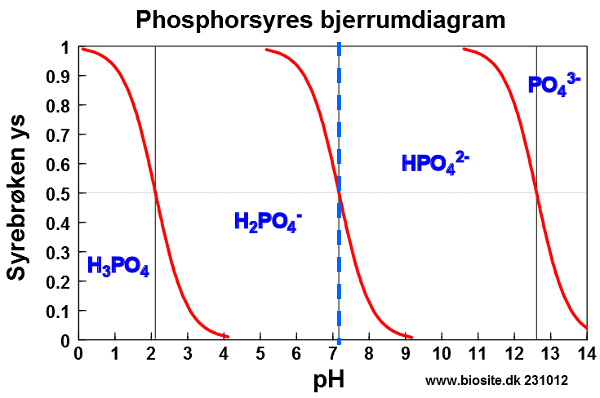
Den stiplede blå linje markerer pH = 7,2. Det ses af díagrammet, at denne linje skærer den røde kurve for [H2PO4-]/[HPO42-]-ligevægten på midten (ys = 0,5). Dvs. at [H2PO4-] = [HPO42-]. Det ses videre, at de røde kurver for ligevægte, hvor H3PO4 og PO43- indgår, ikke skærer den blå linje, og man kan derfor se bort fra deres koncentrationer. De to sidste koncentrationer er ca. 105 gange mindre end de to første, da deres pKs-værdier (markeret med sorte lodrette striber) er ca. 5 enheder fra pH.
Svaret bliver derfor: [H2PO4-] = [HPO42-] = 4,5·10-4 M og [H3PO4] = [PO43-] ≈ 0 M.
Svar #3
05. august 2023 af Cassidyy
M2023, jeg skal også bruge koncentrationen af PO43- og H3PO4. Hvordan findes denne?
Svar #4
05. august 2023 af M2023
#3. Du bruger #1 (med enkelte rettelser)...
pH = pKs + log(|B|/|S|)7,21 = 2,12 + log([H2PO4-]/[H3PO4]) ⇒ [H3PO4] = 10-5,09·[H2PO4-]
7,21 = 7,21 + log([HPO42-]/[H2PO4-]) ⇒ [HPO42-] = [H2PO4-]
7,21 = 12,67 + log([PO43-]/[PO42-]) ⇒ [PO43-] = [PO42-]·10-5,46
[H3PO4] + [H2PO4-] + [HPO42-] + [PO43-] = 9·10-4 M
Da [H3PO4] og [PO43-] begge er meget mindre end [H2PO4-] og [HPO42-], som er ens, så kan sum-ligningen omskrives til...
[H3PO4] + [H2PO4-] + [HPO42-] + [PO43-] = 9·10-4 M ⇒
2·[H2PO4-] ≈ 9·10-4 M ⇒
[H2PO4-] = 4,5·10-4 M.
Dette giver...
[H3PO4] = 10-5,09·4,5·10-4 M = 3.7·10-9 M
[H2PO4-] = 4,5·10-4 M
[HPO42-] = 4,5·10-4 M
[PO43-] = 10-5,46·4,5·10-4 M = 1,6·10-9 M
Svar #6
05. august 2023 af M2023
#4. Rettelse...7,21 = 12,67 + log([PO43-]/[HPO42-]) ⇒ [PO43-] = [HPO42-]·10-5,46
Svar #8
06. august 2023 af M2023
#7. Fordi...
pH = pKs + log([B]/[S]) ⇒
log([B]/[S]) = pH - pKs ⇒
[B]/[S] = 10pH - pKs ⇒
[B] = [S]·10pH - pKs
Svar #9
06. august 2023 af Cassidyy
Hvad med for syren?
For facitmæssigt har de: [H3PO4] = 102,21-7,21 * [H2PO4-]
Som jeg ville tro ser således ud: [S] = 10pKs-pH * [B]
Medens jeg får formlen til at være følgende: [S] = [B] / (10pKs-pH)
Svar #10
06. august 2023 af M2023
#9. Det, som du skriver, er det samme som #7...
pH = pKs + log([B]/[S]) ⇒
log([B]/[S]) = pH - pKs ⇒
[B]/[S] = 10pH - pKs ⇒
[B] = [S]·10pH - pKs ⇒
[S] = [B]·10pKs - pH
Lige et råd: Hvis du skriver "Universitet/videregående" som niveau i overskriften, så vil lektiehjælperne antage, at de ikke behøver at skrive mellemregninger. Prøv i stedet at skrive "A-niveau", det vil som regel give flere detaljer fra starten.
Svar #11
06. august 2023 af Cassidyy
Ok tak, men hvordan går jeg fra [B] = [S]·10pH - pKs til [S] = [B]·10pKs - pH?
Svar #12
06. august 2023 af M2023
#11
[B] = [S]·10pH - pKs ⇒
[S] = [B]/10pH - pKs ⇒
[S] = [B]·10-(pH - pKs) ⇒
[S] = [B]·10pKs - pH
Skriv et svar til: Koncentrationer og pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



