Kemi
Ioner
Cl- har modtaget en elektron.
Har jeg forstået princippet korrekt?
God weekend.
Svar #2
22. august 2014 af LeonhardEuler
#0 og #1
Det er inkorrekt.
#0
Kan du uddybe, hvornår denne proces forekommer? I hvilket tilfælde?
Svar #3
22. august 2014 af Hippocampus (Slettet)
#2
Nej, det er korrekt. 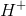 er et hydrogenatom, der har mistet en elektron. Derfor er det fysisk det samme som en proton.
er et hydrogenatom, der har mistet en elektron. Derfor er det fysisk det samme som en proton. 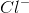 er et chloridatom, der har optaget en elektron.
er et chloridatom, der har optaget en elektron.
Svar #4
22. august 2014 af mathon
H+ har ikke noget at afgive.
men
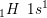 afgiver en elektron og bliver til
afgiver en elektron og bliver til ![\small \small \left [_{1}H \right ]^+](https://media.studieportalen.dk/images/equations/sGZl_Bt4JQr2z54DzQbMLQ==.gif)
eller noteret
H ---> H+ + 1 e-
Cl- kan ikke modtage elektroner
men
![\small \small _{17}Cl\, \, \left [ Ne \right ] \, \, 3s^2\; 3p^5](https://media.studieportalen.dk/images/equations/pFPv1LiJvvEE7kgIAiR2dQ==.gif) modtager en elektron og bliver til
modtager en elektron og bliver til ![\small \small \left [_{17}Cl\, \, \left [ Ar \right ] \right ]^-](https://media.studieportalen.dk/images/equations/lvcRObIPFN7-zIV8Mlw5Lw==.gif)
eller noteret
Cl + 1 e- ---> Cl-
Svar #6
22. august 2014 af LeonhardEuler
#3
#0 mener formentligt saltsyre, som er kovalent bundet. Mon ikke personen har forbundet saltsyre med salt, som er et stof, der er sammensat af lutter ioner.
Desuden kommer din figur i #3 ikke til syne.
Svar #8
22. august 2014 af LeonhardEuler
#3
#0 beskrev det som hydronerne har afsendt sine elektroner og chlorid havde modtaget det - hvilket er en forkert formulering (som du gav #0 ret i). Det er hydrogen atomerne, som har mistet sine elektroner og chloratomerne har modtaget dem.
Det er i hvert fald en mulighed og den anden mulighed er forklaret i #6.
Svar #9
22. august 2014 af Hippocampus (Slettet)
Nej, trådstarter mente, at en hydrogenion er et hydrogenatom, som har afgivet en elektron, og tilsvarende at en chloridion er et chloridatom, som har modtaget en elektron. Har jeg ret i det, trådstarter?
Svar #10
23. august 2014 af Heptan
WilliamSidis jeg tror du er på afveje. Jeg forstår også svaret som "ja".
H+ er H+ fordi den har afgivet en elektron, vice versa
Salt er ikke et enkelt stof, men en type forbindelse (ionforbindelse)
Svar #15
24. august 2014 af LeonhardEuler
Nej, det er det ikke - dog kan processen sagtens finde sted
I elektrolyse af NaCl sker der næsten den omvendte proces
Her opløses saltet natriumchlorid (køkkensalt) 2NaCl (aq) → 2Na+ + 2Cl-
Heraf afgiver chlorid to elektroner (oxidation) 2Cl- → Cl2 (g) + 2e-
og som bliver optaget af hydrogenatomerne i vandetmolekylet (reduktion) 2H2O (l) + 2e- → 2OH- (aq) + H2 (g)
Hvorfor vandmolekylerne reduceres frem for natriumionerne, skyldes at det er en mere energifattig proces.
Svar #16
24. august 2014 af Hippocampus (Slettet)
#12
Jo, helt generelt har den vilkårlige ion 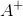 afgivet en elektron og den vilkårlige ion
afgivet en elektron og den vilkårlige ion 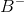 har optaget en elektron.
har optaget en elektron.
Skriv et svar til: Ioner
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



