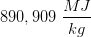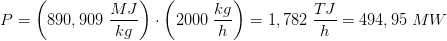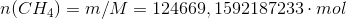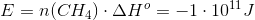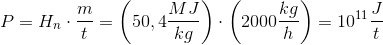Kemi
Termodynamik
30. september 2014 af
CecilieMod (Slettet)
-
Niveau: A-niveau
Hej jeg sidder lidt fast i en opgave, så håber nogle kan hjælpe, den lyder således:
Et naturgasfyret kraftværk forbrænder 2000 kg methan i timen
CH4(g) + 2O2(g) --> CO2(g) + 2H2O(g)
Først er jeg blevet bedt om at regne standard entalpi tilvæksten, som jeg har fået til: -802,51 kJ/mol.
I den næste del af opgaven er jeg blevet bedt om at regne varmeudviklingen pr time. Det er her jeg er gået i stå.
Så lidt hjælp tak
Skriv et svar til: Termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.