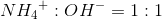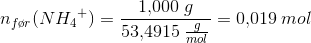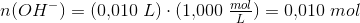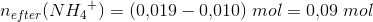Kemi
reaktionsskemaer og mol beregning
Jeg har en stødpudeopløsning af 1,000 g ammoniumchlorid og 10,00 lm 1,000 M natriumhydroxid i en 100 ml målekolbe, når stoffet er opløst fyldes til stregnen med H2O.
Jeg har opstillet en resktionsligning således;
NH4+ + OH- + Na+ + cl- --> NH3 + Na+ + Cl- + H2O
Forenklet fordi Cl- og Na+ blot er "tilskuere"
NH4+(aq) + OH-(aq) --> NH3(aq) + H2O(l)
Jeg skal så beregne mol før og efter reaktionen og bliver så i tvivl om hvorledes jeg skal forholde mig til mængden?
En venlig kemiker der kan komme med et hint?
Svar #2
01. december 2015 af Anibas92 (Slettet)
Tusind tak for dit svar
Det giver god mening jeg var i tvivl om man bare kunne trække fra på den måde efter reaktionen.
Skriv et svar til: reaktionsskemaer og mol beregning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.