Kemi
pufferopløsning - bestem forholdet mellem stofmængdekoncentrationer
Opgaven:
Mange rengøringsmidler indeholder ammoniak.Deklarationen på en flakse rengøringsmiddel oplyser pH = 10,4. Beregn forholdet mellem stofmængdekoncentrationerne af NH3 og NH4+.
Hvordan gør jeg det? Jeg formoder, jeg skal anvende pufferligningen og syrens pKs-værdi på 9,25 samt den givne pH men hvordan løser jeg denne opgave?
Svar #1
02. marts 2016 af Soeffi
#0 Beregn forholdet mellem stofmængdekoncentrationerne af NH3 og NH4+.
Du skal finde:
![\frac{\left [ NH_3 \right ]}{\left [ NH_4^+ \right ]}](https://media.studieportalen.dk/images/equations/DPVRja1gJ3V992zqiqApLQ==.gif)
Svar #2
02. marts 2016 af 321bj (Slettet)
#1
Men hvordan finder jeg det, når koncentrationerne ikke er givet?
Skal jeg omregne pH til koncentrationen af oxonium og beregne koncentrationen af hydroxid ud fra Kv og oxonium-koncentrationen?
Og hvis dette er tilfældet, svarer oxonium-koncentrationen så til syrens koncentration og svarer hydroxidkoncentrationen til basens koncentration?
Svar #3
02. marts 2016 af Soeffi
#2 Men hvordan finder jeg det, når koncentrationerne ikke er givet?
Du skal ikke finde koncentrationerne, kun forholdet mellem dem.
Svar #6
02. marts 2016 af 321bj (Slettet)
#5
men jeg forstår ikke, hvordan jeg kan bestemme forholdet mellem deres stofmængdekoncentrationer andet end syren er i nævner og basen i tæller og log(cbase/csyre) = log(cbase) - log(csyre). Skal jeg bruge syrens pKs og pH til noget?
Svar #7
02. marts 2016 af Soeffi
#6 Du har pufferligningen:
![pH=pK_s+log(\frac{\left [ NH_3 \right ]}{\left [ NH_4^+ \right ]})](https://media.studieportalen.dk/images/equations/pv47O9QN3AM0VG6Uk5W3jw==.gif)
Du kender pH og pKs. Du skal finde det, som står i parentesen til logaritmefunktionen.
Svar #8
02. marts 2016 af 321bj (Slettet)
#7
men hvordan finder jeg det?
pH-pKs = 1,15
skal jeg bare tage logaritmen til det?
Svar #10
02. marts 2016 af 321bj (Slettet)
#9
tak for svar. bare for at være på den sikre side, er det rigtigt resultatet bliver 14,13?
Skriv et svar til: pufferopløsning - bestem forholdet mellem stofmængdekoncentrationer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









![pH=pK_s+log(\frac{\left [ NH_3 \right ]}{\left [ NH_4^+ \right ]})\Rightarrow \frac{\left [ NH_3 \right ]}{\left [ NH_4^+ \right ]} = 10^{pH-pK_s}](https://media.studieportalen.dk/images/equations/sOO9k61YwupVKlELu0R9qg==.gif)
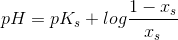
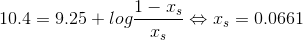
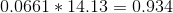
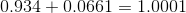 , altså ca. 100%. Så ja, dit svar er rigtigt.
, altså ca. 100%. Så ja, dit svar er rigtigt.