Kemi
mængdeberegning
jeg søger hjælp til en opgave som jeg er gået helt i stå ved.. opgaveformuleringen er linket
tak på forhånd!
Svar #1
12. marts 2017 af Annaduvedhvem
jeg har set lidt på nettet og der fandt jeg bl.a. det her https://www.studieportalen.dk/forums/thread.aspx?id=1672642 men jeg kan ikke finde ud af hvad jeg skal indsætte hvor..
Svar #3
12. marts 2017 af mathon
Brug absorbanskurven fra foregående opgave til at bestemme molariteten.
https://www.studieportalen.dk/forums/thread.aspx?id=1739688
Svar #4
12. marts 2017 af Skaljeglavedinelektier
Brug de nedenstående formler (i den giv rækkefølge) - du skal bruge resultater fra foregående opgaver omkring Lambert-Beers lov:
1) ![[A]=\frac{A}{\epsilon _\lambda\cdot l }](https://media.studieportalen.dk/images/equations/kZpCXsHs83M9TQ0TVIJGCQ==.gif)
2) 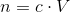
3) 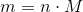
Resultatet er ca. 0,957 mg.
Svar #5
15. marts 2017 af Annaduvedhvem
hvad er forskellen på [A] og A
og kan du beskrive kort hvad n, V, m og M er...
Svar #6
15. marts 2017 af Skaljeglavedinelektier
[A] er den aktuelle koncentration af dit stof.
A er absorbansen.
ελ er den molare absorptionskoefficient.
l er kuvettebredden.
n er stofmængden.
c er koncentrationen.
V er volumen.
m er massen.
M er molarmassen.
Svar #8
17. marts 2017 af Skaljeglavedinelektier
Indsæt i formlerne i #4. Skriv ned, hvad du gør, og så vil jeg gerne guide dig.
Svar #10
17. marts 2017 af Skaljeglavedinelektier
Mon ikke der er blevet brugt Lambert-Beers lov forud for denne opgave? Sandsynligvis vil man skulle vise, at nogle måleresultater er i overensstemmelse med Lambert-Beers lov. Hældningskoefficient, givet du har lavet det rigtigt, vil være givet ud ved 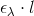 .
.
Prøv at lægge den forudgående opgave ind.
Svar #11
18. marts 2017 af Annaduvedhvem
Jeg forstår godt at jeg skal sætte mine værdier ind i formlen i #4, men har bare svært ved at finde ud af hvilke af mine tal der er hvad.. jeg har nemlig ikke fået en særlig god gennemgang i det her med mængdeberegning, så håber du vil bære over med mig..
Jeg har skam brugt Lambert-Beers lov i den forrige opave (jeg har linket et billede af hvad jeg fik givet ud ved 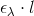 )
)
Svar #12
18. marts 2017 af Skaljeglavedinelektier
Det helt fint. Vi prøver sammen så.
Hældningskoefficienten, de 9771,2 (hvilken enhed vil den få?), er ελ · l. Dette ved vi, da Lambert-Beers lov er givet ved:
A = ελ · l · [A]
Nu til din nye opgave om at udregne indholdet af carminsyre i bolsjet:
Vi finder først koncentrationen af carminsyre i bolsjet ved brug af Lambert-Beers lov - vi kender netop ελ · l fra den foregående opgave, og vi får oplyst, at absorbansen er målt til 0,38 ved de 518 nm:
![A =\epsilon_\lambda \cdot l\cdot [A]\Leftrightarrow [A]=\frac{A}{\epsilon_\lambda \cdot l}=\frac{0,38}{9771,2}=?](https://media.studieportalen.dk/images/equations/bvyEKyRVod6IfOV9FXo0HA==.gif)
Herved finder vi koncentrationen af carminsyre i bolsjet. Vi bestemmer herefter stofmængden af carminsyre, da vi nu kender koncentrationen og får oplyst volumen til 50,0 mL:
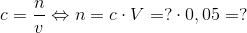
Da vi kender stofmængden kan vi bestemme massen, da vi får oplyst molarmassen af carminsyre til 492,39 g/mol:
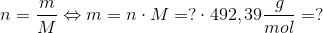
Herved har du bestemt massen - husk det skal være i mg. Jeg har ikke lavet udregningerne færdig eller skrevet enheder ind - det synes jeg, du selv skal gøre. Jeg tjekker det gerne efter, og du skriver bare, hvis der er noget, du ikke forstår, eller hvis der er noget, der er forklaret dårligt.
Svar #13
18. marts 2017 af Annaduvedhvem
Mange tusind tak! jeg har sendt det færdige arbejde i en privat besked, som du lige kan tjekke når du får tid
Skriv et svar til: mængdeberegning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



 - ifølge #0 - ikke er kendt, er #6 ikke meget bevendt.
- ifølge #0 - ikke er kendt, er #6 ikke meget bevendt.