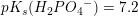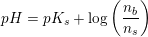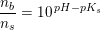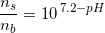Kemi
Bufferopløsning
23. september 2017 af
didodawood (Slettet)
-
Niveau: B-niveau
Til fremstilling af bufferopløsningen anvendes der 5 mL af en 1 M NaCL opløsning 2,5 mL af en 1 M Na2HPO opløsning og et volumen Af en 0,1 M KH2PO4 opløsning. Der tilsættes rent vand til et endeligt volumen på 100 mL. Spørgsmålet er så beregn hvor stort et volumen i ml af KH2PO4 opløsningen der skal bruges til fremstilling af den færdige bufferopløsning. Og svaret er at der tilsættes 25 mL 0,1 M KH2PO4 ... kan slet ik se hvorfor det kan give 25 mL
Skriv et svar til: Bufferopløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.