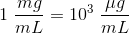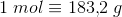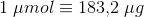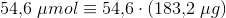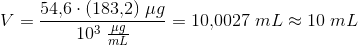Kemi
Hvad er volumen?
Hej,
Adrenalin findes i en koncentration på 1 mg/mL.
Hvilken volumen af adrenalinopløsningen skal der til, hvis man vil have 54,6 μmol?
Molare masse = 183,2 g/mol.
Svar #1
05. juli 2015 af KimT.T.
Der er to måder at gå til dette problem på.
1) Du skal først og fremmest omregne din adrenalinkoncentration (c = 1 mg/mL) fra enheden mg/mL til mmol/mL. Dette gør du ved at anvende din molare masse (Mw). Tag udgangspunkt i en opløsning på V = 1 mL, så må det gælde, at du har en masse m = 1 mg. Brug så
n = m / Mw
Mw = 183,2 g/mol = 183,2 mg/mmol
(jeg omregner molarmassen fra enheden g/mol til mg/mmol - dette giver dog samme tal, idet jeg forkorter med samme værdi i både tæller og nævner)
n = 1 mg / 183,2 mg/mmol = 0,005459 mmol
Så din koncentration må være lig med
c = n / V
c = 0,005459 mmol / 1 mL = 0,005459 mmol/mL
Nu hvor du har omregnet din adrenalinkoncentration fra mg/mL til mmol/mL ?kan du beregne voluminet, der skal til for at have n = 54,6 μmol; omregn dog først stofmængden fra μmol til mmol, så enheden passer med din koncentration
1 μmol = 0,001 mmol
n = 54,6 μmol = 0,0546 mmol
Brug nu at
c = n / V ⇔ V = n / C
V = 0,0546 mmol / 0,005459 mmol/mL = 10,00 mL ≈ 10 mL
2) Den anden metode er, at du starter med at omregne 54,6 μmol til en masse i mg - i stedet for at omregne din koncentration fra mg/mL til mmol/mL. Herfra kan du på samme måde anvende din koncentration til at bestemme det nødvendige volumen.
Svar #2
05. juli 2015 af Hijsa
Tak for svaret. Dejligt at du vil bruge tid på at hjælpe :)
Du siger at vi tager udgangspunkt i at vi har en opløsning på V = 1 mL. Er det bare noget man altid tager udgangspunkt i? Ville det ingen betydning have for facit?
Forstår heller ikke hvorfor 1 mL betyder at massen er 1 mg?
Svar #3
05. juli 2015 af Hijsa
Jeg har nogle noter omkring opgaven, og her har jeg skrevet:
Jeg finder masse ved at sige m = n*M = 54,6*10^-6 mol * 183,2 g/mol * 10^3 = 10,0027 mg.
Dernæst finder jeg volumen ved at sige:
V = m/c = 10,0027 mg/ (1 mg/mL) = 10 mL. Altså jeg kan se det går op med enhederne, men jeg har aldrig hørt om en formel der hed V = m/c. Facit giver i princippet det samme men er det rigtigt at bruge denne metode også?
Skriv et svar til: Hvad er volumen?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.