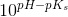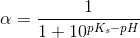Kemi
Syrer og baser - struktur
Hej SP
Jeg sidder med en opgave, hvor jeg er kommet igennem noget af det, men nu sidder jeg fast. Opgaven lyder:
En af de stoffer, man kan finde i stor mænde i baldarinplanten, er en monohydron carboxylsyre
Fra 100 g tørret baldarinrod isoleres 0,254 g af den ildelygtende syre. Syren opløses i vand. Opløsningens volumen er 20,0 mL.
En elev udfører en titrering af denne syreopløsning, idet der titreres med en 0,0986 M natirum hydroxidopløsning. Titrerkurven ses nedenfor.

a) Angiv en egnet indikator for kolorimetrisk titrering af syren med natriumhydroxidopløsningen.
Denne opgave kunne jeg godt selv.
b) Bestem syrens molare masse.
Bestemte jeg til at være ca. 101,82 g/mol.
c) Beregn, hvor stor en procentdel af den ildelugtende syre, der findes på baseform i urin med pH 4,5 og temperaturen 25 °C.
Ud fra titrerkurven aflæser jeg syrens pKs til at være ca. 5 (ved ikke om dette er rigtigt). Tænker at jeg måske skal bruge pufferligningen på en eller anden måde?
pH = pKs + log (nb / ns) <=> 4,5 = 5 + log (nb / ns) ?
Den ildelugtende syre anvendes i parfumeindustrien til at fremstille en ester, som dufter af æble. Esteren har molekyleformlen C7H14O2.
d) Tegn to mulige strukturer af esteren, og navngiv dem. Den ene skal udvise stereoisomeri, mens den anden ikke skal udvise stereoisomeri.
Her er jeg også kommet med et bud, men jeg er ikke sikker på, at det er rigtigt...

a) Pentan-1-oat?
b) 2,3-dimethylpropan-1-oat, denne har asymmetrisk C-atom, hvilket giver anledning til stereoisomeri?
Mange tak for hjælpen!
Svar #2
06. oktober 2015 af Malene121
#1
Sidder netop med samme opgave. tænker er der ikke en anden måde at kunne løse opgaven på?
Svar #3
06. oktober 2015 af Hrylla
#1
Tak mathon!
Tror godt jeg kan se, hvad du gør. Det har noget at gøre med syrebrøken, ikke?
pH = pKs + log (1-Ys / Ys)
Hvor Ys er syrebrøken, så man kan bare sige 1-Ys = Yb. Takker, det var lige det skub, jeg havde brug for.
Svar #6
27. februar 2016 af Kemifjols (Slettet)
Hvordan ser de to mulige strukturer ud for esteren i opgave d?
Skriv et svar til: Syrer og baser - struktur
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










![pH=pK_s+\log_{10}\left (\frac{\left [ B \right ]}{\left [ S \right ]} \right )=pK_s+\log_{10}\left ( \frac{\alpha }{1-\alpha } \right )](https://media.studieportalen.dk/images/equations/g8-9h2c2F_oZELJUDCDkUQ==.gif)
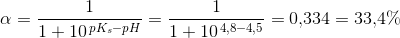
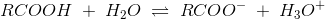
![pH=pK_s+\log\left ( \frac{\left [ B \right ]}{\left [ S \right ]} \right )](https://media.studieportalen.dk/images/equations/DXl8wkZMUYpfFza6AeO9gg==.gif)
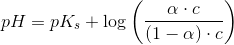
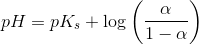
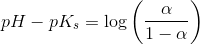
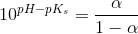
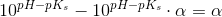
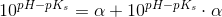
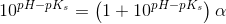
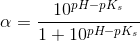 forkortes med
forkortes med