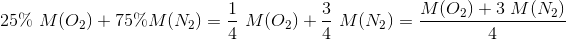Kemi
Fysik/kemi molarmasse af atmosfærisk luft
29. april 2016 af
bonnielarsen (Slettet)
-
Niveau: B-niveau
Vi har fået afvide at atmosfærisk luft består af 25% O2 og 75% N2
og at molarmassen bliver 29g/mol
(2·16+(2·14,01)·3)/4 men er ikke sikker på hvorfor jeg skal gange med 3 og dividere med 4 men får det rigtige resultat, nogle der kan forklarer hvorfor?
Skriv et svar til: Fysik/kemi molarmasse af atmosfærisk luft
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.