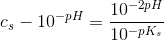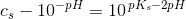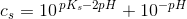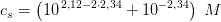Kemi
Formel kocentration
21. oktober 2016 af
Jenskristiann
-
Niveau: A-niveau
"I en cola bestemmes pH til 2,34.
Hvad er den formelle koncentration of fosforsyre hvis vi antager, at pH-værdien udelukkende bestemmes af fosforsyre?
pKa(1) = 2,12 for fosforsyre."
Jeg er på bar bund..
Jeg tænkte på noget i rening af:
[H3O+] = 10^-pH = 10^-2,34 = 4,57 x 10^-3 M.
Men derfra kan jeg ikke gennemskue, hvad man skal (hvis det overhovedet er rigtigt).
Skriv et svar til: Formel kocentration
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





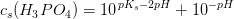
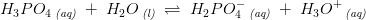
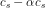
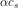
![\frac{ \left [ H_2PO_4^{-}\right ]\cdot \left [ H_3O^{+}\right ]}{\left [ H_3PO_4\right ]}=K_s](https://media.studieportalen.dk/images/equations/JrbCLyoPP-zq13LHKXcDqA==.gif)
![\frac{ \left [ H_3O^{+}\right ]^2}{c_s-\left [ H_3O^{+}\right ]}=K_s](https://media.studieportalen.dk/images/equations/ujb1JVO_vC8NPDZlcS3Sjw==.gif)
![c_s-\left [ H_3O^{+}\right ]=\frac{ \left [ H_3O^{+}\right ]^2}{K_s}](https://media.studieportalen.dk/images/equations/Wz8xxQUb0Jiypu52LVqfEQ==.gif)