Grundstoffer
Definitionen på et grundstof er en forbindelse, der udelukkende består af samme slags atomer. Som bekendt består atomer af et bestemt antal elektroner, protoner og neutroner, der er specifikt for netop det atom. Eksempelvis er ilt 

Man har, foruden en inddeling efter atomnummer, også inddelt grundstofferne i grupper efter deres egenskaber. De tre overordnede kategorier er metaller (link), halvmetaller og ikke-metaller. Disse tre kategorier og deres mest interessante undergrupper gennemgås i de følgende afsnit.
Metaller
Kategorien metaller dækker over alle de grundstoffer, der har følgende fire egenskaber tilfælles.
- De har metalglans (Skinner ved slibning eller overskæring).
- De er gode varme- og strømledere.
- De danner positive ioner.
- De er faste ved stuetemperatur (Dog med undtagelse af kviksølv (Hg))
Indenfor metaller haves følgende inddelinger: Alkalimetaller, lanthanider, jordalkalimetaller, actinider og overgangsmetaller. Heraf vil kun de første to blive uddybet yderligere i denne artikel. For en grundigere beskrivelse af metaller se kompendiet Metaller.
Alkalimetaller
Alkalimetaller dækker over alle grundstofferne i første hovedgruppe af det periodiske system, på nær hydrogen, og omfatter altså lithium, natrium, kalium, rubidium, cæsium og francium. Det er karakteristisk for disse grundstoffer, at de alle kun har én elektron i yderste skal. Dette betyder i praksis, at de kun afgiver en enkelt elektron, og derfor som udgangspunkt danner ioner med en positiv ladning på 1. Eksempelvis 

Lanthanider
Lanthaniderne inkluderer grundstofferne med atomnummer fra 57-71, og disse er karakteriseret ved at kunne danne en ion med en positiv ladning på 3. Eksempelvis 

Halvmetaller
Halvmetallerne er kendetegnet ved både at besidde metalliske og ikke-metalliske egenskaber. Gruppen omfatter syv grundstoffer: bor, silicium, germanium, arsen, antimon, tellur og polonium. Ser man på det periodiske system, er disse grundstoffer placeret netop i grænseområdet mellem metallerne og ikke-metallerne.
Ikke-metaller
Denne gruppe af grundstoffer er karakteriseret ved en høj elektronegativitet. Det vil sige, at disse grundstoffer tiltrækker elektroner bedre end andre, hvorfor de ikke så let afgiver en elektron. Derudover har de ikke nogle metalliske egenskaber. Igen skelnes mellem tre inddelinger af ikke-metallerne: ædelgasser (Link), halogener og andre ikke-metaller.
Halogener
Halogenerne omfatter hele 17. hovedgruppe i det periodiske system, og det vil altså sige fluor, chlor, brom, iod og astat. Disse grundstoffer er karakteriseret ved at have syv elektroner i yderste skal, og med deres høje elektronegativitet dannes ofte en ion med en negativ ladning på 1. Eksempelvis 





Radioaktive grundstoffer
Et radioaktivt grundstof adskiller sig fra andre grundstoffer ved spontant at henfalde. Det vil sige, at grundstoffet omdannes til enten et andet grundstof eller til en anden isotop. Altså et atom hvor antallet af neutroner ikke er lig med antallet af protoner. Et grundstof er radioaktivt, hvis dets kerne er ustabil. Det kan den være, hvis den har et overskud af energi eller kernepartikler. Ved sidstnævnte kan man forestille sig, at heliums (He) atomkerne indeholder fire neutroner i stedet for to, som man normalt ser. Ser man på henfaldstyper, så er eksempelvis alfa-henfald karakteriseret ved, at atomkernen udsender to protoner og to neutroner (altså en heliumkerne), og dermed omdannes grundstoffet til det grundstof, hvis atomnummer er to numre lavere. Uran (U) vil altså henfalde til thorium (Th) under udsendelse af en heliumkerne.
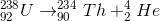
Denne type henfald er den mest udbredte for grundstoffer, hvis atomnummer er større end 82. Indenfor radioaktivitet udgør alfa-henfald sammen med beta-henfald og gamma-henfald, de tre mest hyppige typer. Det er vigtigt at bemærke, at disse henfald sker spontant, altså helt af sig selv. Hastigheden, hvormed grundstofferne henfalder, er dog vidt forskellige, og man bestemmer derfor en halveringstid for grundstoffet. Halveringstiden angiver, hvor langt tid en given stofmængde tager om at halveres. Bemærk, at de radioaktive grundstoffer ikke udgør en gruppe af grundstoffer på lighed med metaller, halvmetaller og ikke-metaller, men at de radioaktive grundstoffer findes på tværs af denne inddeling.

