Kemi
forskel på en svag syreopløsning og en pufferopløsning
Hej derude :D
ja overskriften siger sig selv, hvad er forskellen på en svag syreopløsning og en pufferopløsning? :D
tak på forhånd
Svar #1
11. august 2014 af bbdk
Der er ikke nogen forskel. En svag syre er en buffer. Du kan prøve at kigge på ligevægte og Le Chateliers princip for en bedre forståelse af hvordan en buffer virker.
Svar #2
11. august 2014 af mathon
En svag syre kaldes ikke altid for en buffer/puffer.
Hvis en svag syres dissociationsgrad/ioniseringsgrad α << 0,05
approksimeres
1 - α ≈ 1
dvs
[HX] = cs·(1-α) ≈ cs den aktuelle syrekoncentration kan approksimeres dens formelle koncentration.
For en effektiv puffer
med
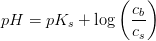
skal
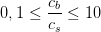
hvorfor der til den svage syre HX, skal tilsættes dens korresponderende svage base X-
så
[HX] ≠ cs
hvorved
pufferkapaciteten
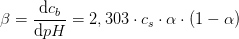
får en rimelig størrelse,
således at definitionen på en puffer med en rimelig pufferkapacitet er opfyldt:
en brugbar puffer er
en vandig opløsning af en svag syre og dens korresponderende svage base, hvis pH-værdi ikke ændres
kendeligt selv ved tilsætning af et mindre volumen stærk syre eller stærk base.
Der er således forskel på en opløsning af en svag syre og en puffer.
Svar #3
11. august 2014 af bbdk
Gider du smide en kilde mathon? Jeg har haft kemi på C, B og A niveau samt uorganisk på uni og er aldrig stødt på udtrykket brugbar buffer. Jeg har kigget i mine lærebøger og googlet og kan ikke finde noget. Måske bruger jeg forkerte søgetermer.
Svar #4
12. august 2014 af Heptan
Selvfølgelig er der forskel! Vi kan jo antage, at en svag syre stort set ikke dissocieres i en vandig opløsning ==> dårlig puffer.
For at have en puffer er vi nødt til at have en rimelig mængde af både syren og dennes korresponderende base.
Vi siger, at en puffer har den største pufferkapacitet for pH = pKs, og dette kan opnås ved at tilsætte lidt NaOH i en svag syreopløsning.
Svar #5
12. august 2014 af Heptan
#3 Bogstaveligt talt er en brugbar puffer, en buffer man kan bruge til noget. Så ordet "brugbar" er bare et adjektiv.
Hvis der er for lidt af den korresponderende base i den pufferopløsning man har lavet i lab, har man lavet en dårlig puffer, som svinger meget i pH.
En brugbar puffer ændrer ikke pH i nævneværdig grad, selvom man tilsætter en stærk syre eller base.
Svar #6
12. august 2014 af bbdk
Jeg bestrider skam ikke mathon, som jeg har stor respekt for. Jeg ville bare gerne læse lidt mere om det, da jeg troede at definitionen på en svag syre er en ufuldstændig dissociation og dermed en ligevægt. Og med en ligevægt følger naturligt Le Chateliers princip. Jeg er helt med på at du ikke har nogen reel ligevægt hvis du kun har 3 molekyler flussyre i din opløsning, sådan rent statistisk.
Svar #7
12. august 2014 af mathon
#6
En svag syre er moderat dissocieret.
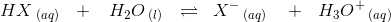
ligevægtsmolariteter (1-α)·cs α·cs α·cs
hvor α << 0,05 dvs stærkt forskudt til venstre.
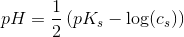
Tilsætning af lidt stærk syre eller stærk base vil ændre pH mærkbart.
For α → 0,5 dvs [X- ] → [HX]
haves en puffer
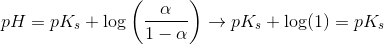
dvs pH kun afviger lidt fra pKs
selv ved tilsætning af et mindre volumen stærk base eller stærk syre.
Skriv et svar til: forskel på en svag syreopløsning og en pufferopløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









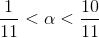
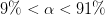 med variation på pH's 1. decimal
med variation på pH's 1. decimal