Kemi
Beregn syrens koncentration
Hej
Er der nogen der ved, hvordan man kan syrernes koncentration ud fra graferne?
Svar #2
05. marts 2015 af MariaJ3 (Slettet)
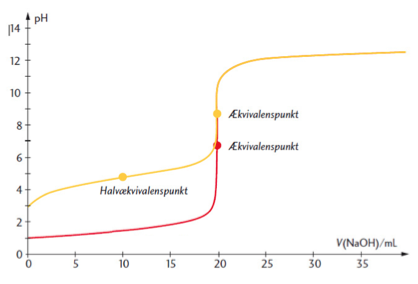
Det skal lige siges, at den gule kurve er ethansyre, og den røde kurve er saltsyre. Begge syrer er titreret med 0,1M NaOH.
Svar #3
05. marts 2015 af MariaJ3 (Slettet)
Er det ved at benytte, at nNaOH = nethansyre ved ækvivalenspunktet? For man kan jo finde nNaOH, som jo så er lig nethansyre. Og så kan man dividere det med Vethansyre, og så har man koncentrationen?
Svar #4
05. marts 2015 af MariaJ3 (Slettet)
Er der desuden nogen der kan svare på, hvorfor ethansyres omslagspunkt har en højere pH værdi end saltsyres? Jeg kan ikke lige gennemskue den?
Svar #5
05. marts 2015 af Soeffi
Ved halvækvivalenspunktet er pH lig syrens pKs værdi.
Ved ækvivalenspunktet er syren omdannet helt til sin korresponderende base. Dette gør, at man kan beregne syrens (oprindelige formelle) koncentration. Den formelle koncentration er antal mol (udissocieret) syre plus antal mol af dens korresponderende base divideret med det rumfang opløsningen havde fra starten.
Grunden til at den svage syre har højere pH værdi ved ækvivalenspunktet er, at den, som nævnt, her er helt omdannet til sin korresponderende base og denne er en svag base, der er i stand til at hæve pH over 7. I modsætning hertil er Cl- - den korresponderende base til HCl - en meget svag base og ikke i stand til at påvirke pH i ækvivalenspunktet.
I blandingen med den svage syre stiger pH hurtigt lige i starten, men flader så ud i et område. Dette område er pufferområdet for den svage syre.
Svar #6
05. marts 2015 af MariaJ3 (Slettet)
Hmm, jeg forstår ikke hvorfor man skal lægge antal mol syre og antal mol base sammen? Ækvivalenspunktet er jo der hvor man har tilsat lige så meget base, som der var syre til at starte med? Og så må det jo bare være stofmængden af basen, der er den samme som stofmængden af syren. Den stofmængde skal så diviceres med den oprindelige volumen, og så har man koncentrationen af syren?
Svar #7
05. marts 2015 af Soeffi
#6Hmm, jeg forstår ikke hvorfor man skal lægge antal mol syre og antal mol base sammen? Ækvivalenspunktet er jo der hvor man har tilsat lige så meget base, som der var syre til at starte med? Og så må det jo bare være stofmængden af basen, der er den samme som stofmængden af syren. Den stofmængde skal så diviceres med den oprindelige volumen, og så har man koncentrationen af syren?
Ved ækvivalenspunktet er syrens aktuelle koncentration lig nul eller tæt på. Derfor er det oprindelge formelle antal mol syre lig med det aktuelle antal mol korrespondeende base.
Svar #8
06. marts 2015 af Heptan
Jeg er ikke helt enig i Soeffi; man måler ikke den aktuelle koncentration i ækvivalenspunktet, hvordan skulle man gøre det? Hvad man observerer er, at det stejleste sted på titrerkurven angiver et volumen og dermed en stofmængde titrator, som tilsvarer en stofmængde titrand. Det vil til ethvert tidspunkt give mening at der hele tiden er en aktuel koncentration, om lille, af titranden. Start svarer til ligevægten, hvor vi har en formel syrekoncentration, mens ækvivalenspunktet svarer til ligevægten, hvor vi har en tilsvarende formel basekoncentration (korrigeret for volumen). Man kan opnå samme pH som ækvivalenspunktet ved at lave en ren opløsning af basen med samme formelle koncentration.
Svar #9
06. marts 2015 af MariaJ3 (Slettet)
Som jeg forstår det:
I ækvivalenspunktet har man tilsat lige så meget base, som der var syre til at begynde med, altså har vi her:
nNaOH = nsyre
Så kan man jo finde nNaOH da man kender den tilsatte volumen og koncentrationen. Og så kan man jo også finde nsyre, da nNaOH = nsyre.
Og så kan man dividere nsyre med den oprindelige volumen, og så har man koncentrationen? Er det korrekt?
Så kan jeg dog stadig helt forstå, hvorfor ethansyres omslagspunkt har en højere pH værdi end saltsyres? Kan I prøve at forklare det igen? :-)
Svar #10
06. marts 2015 af Heptan
#9
Ja, så alle de stofmængder du har nævnt er jo formelle. Man kan tænke på det som, at man tager lige store mængder tørt NaOH og tør syre, og lader dem reagere fuldstændigt. Så får man en mængde tør base, som man så hælder i rent vand. Da det er en base, vil pH > 7. I en vandig opløsning er det ikke helt det samme, men ækvivalenspunktet vil have samme pH som en ren opløsning af den korresponderende base.
Vi har jo at gøre med en ligevægt, så der vil hele tiden være både syre og base til stede. Når man tilsætter stærk base, forskyder man ligevægten mod den svage base.
Svar #11
06. marts 2015 af MariaJ3 (Slettet)
Okay, jeg kan bare stadig ikke helt se, hvorfor den ene pH-værdi bliver større end den anden? :-)
Hvilke stoffer der er i opløsnigen ved ækvivalenspunktet?
Svar #12
06. marts 2015 af Heptan
Der er de samme stoffer i opløsningen hele tiden.
I ækvivalenspunktet er syren dog formelt set blevet omdannet helt til base. Man kan så tænke på det som at basen reagerer med vand, og så bliver opløsningen basisk, og vi får en lille smule af syren også fra dissociationen.
Men i virkeligheden er det jo bare en ligevægt vi forskyder hele tiden ved at tilsætte stærk base.
Svar #13
06. marts 2015 af MariaJ3 (Slettet)
Ja okay, men den røde kurve er jo ikke basisk. Det jeg ikke kan forstå er, hvorfor det er, at den ene har en pH-værdi der er højere end den anden. Hvad er det der gør, at ethansyres omslagspunkt har en højere pH værdi end saltsyrens?
Svar #14
06. marts 2015 af Soeffi
#11Okay, jeg kan bare stadig ikke helt se, hvorfor den ene pH-værdi bliver større end den anden? :-)
Hvilke stoffer der er i opløsnigen ved ækvivalenspunktet?
Ved ækvivalenspunktet for titrering af HCl med NaOH er der vand plus NaCl til stede. Dette giver en pH på 7.
I titreringen med ethansyre og NaOH er der Na+ og CH3COO- tilstede i vand. Da CH3COO- er en svag base vil pH være større end 7.
Svar #15
06. marts 2015 af MariaJ3 (Slettet)
Okay, men hvordan hænger det sammen med, at CL- er en meget svag base og dermed ikke i stand til at påvirke pH i ækvivalenspunktet?
Svar #16
06. marts 2015 af Soeffi
#15Okay, men hvordan hænger det sammen med, at CL- er en meget svag base og dermed ikke i stand til at påvirke pH i ækvivalenspunktet?
Det passer perfekt. pH = 7.
Svar #17
06. marts 2015 af Heptan
#13Ja okay, men den røde kurve er jo ikke basisk. Det jeg ikke kan forstå er, hvorfor det er, at den ene har en pH-værdi der er højere end den anden. Hvad er det der gør, at ethansyres omslagspunkt har en højere pH værdi end saltsyrens?
Chlorid er ikke en meget svag base, det er en yderst svag base, hvis man skal følge den danske nomenklatur. Det betyder at den ikke påvirker pH. En svag syre korresponderer en svag base, som altså er stærkere end en yderst svag base. En svag base påvirker pH.
Skriv et svar til: Beregn syrens koncentration
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.