Kemi
Beregning af entropiændring vha. ligevægt
En idealgasreaktion som vist i den vedhæftede fil betragtes.
Spørgsmål d) volder nogle problemer, idet jeg er usikker på, hvordan jeg skal tage højde for trykket.
Jeg har fundet følgende svar til hhv. b) og c):
b) 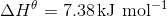
c) 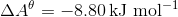
Jeg har prøvet at tage udgangspunkt i Gibbsenergien, 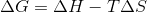 , men kan ikke komme frem til det rigtige resultat, da jeg synes at mangle en eller flere variable til slut. Facitlisten siger,
, men kan ikke komme frem til det rigtige resultat, da jeg synes at mangle en eller flere variable til slut. Facitlisten siger, 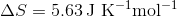
Opgaven er ment som forberedelse til dette års eksamen.
Svar #1
18. oktober 2015 af LOLZ35 (Slettet)
Svar #2
18. oktober 2015 af StofferStøvmus
Det giver ikke det rigtige - når jeg indsætter tallene bliver 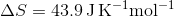 .
.
Tror ikke van't Hoff ligningen kan bruges, da systemet jo ikke er ved standardbetingelser (trykket er 100 bar)
Skriv et svar til: Beregning af entropiændring vha. ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






