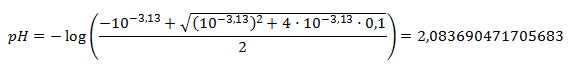Kemi
Udregning af Ph af fx. Citronsyre i en 0.1 M opløsning
Jeg skal udregne Ph værdien en en opløsning af henholdsvis Citronsyre og Vand (0.1 M) samt Ammoniak og Vand (0.1 M).
Det virker rimelig basis, men jeg var syg da klassen lærte om det, og jeg har ingen hjælp kunne finde.
Svar #3
01. november 2015 af Heptan
Citronsyre er en svag syre med pKa1 = 3,13. Der findes en formel til beregning af pH for svage syrer:
pH = 1/2(pKa - log(cs))
hvor cs = 0,1 M
Svar #4
01. november 2015 af Heptan
#1
Man kan med god rimelighed antage at citronsyre er monohydron i rimelige koncentrationer for en pH-værdi med 2 betydende decimaler.
Svar #5
01. november 2015 af mathon
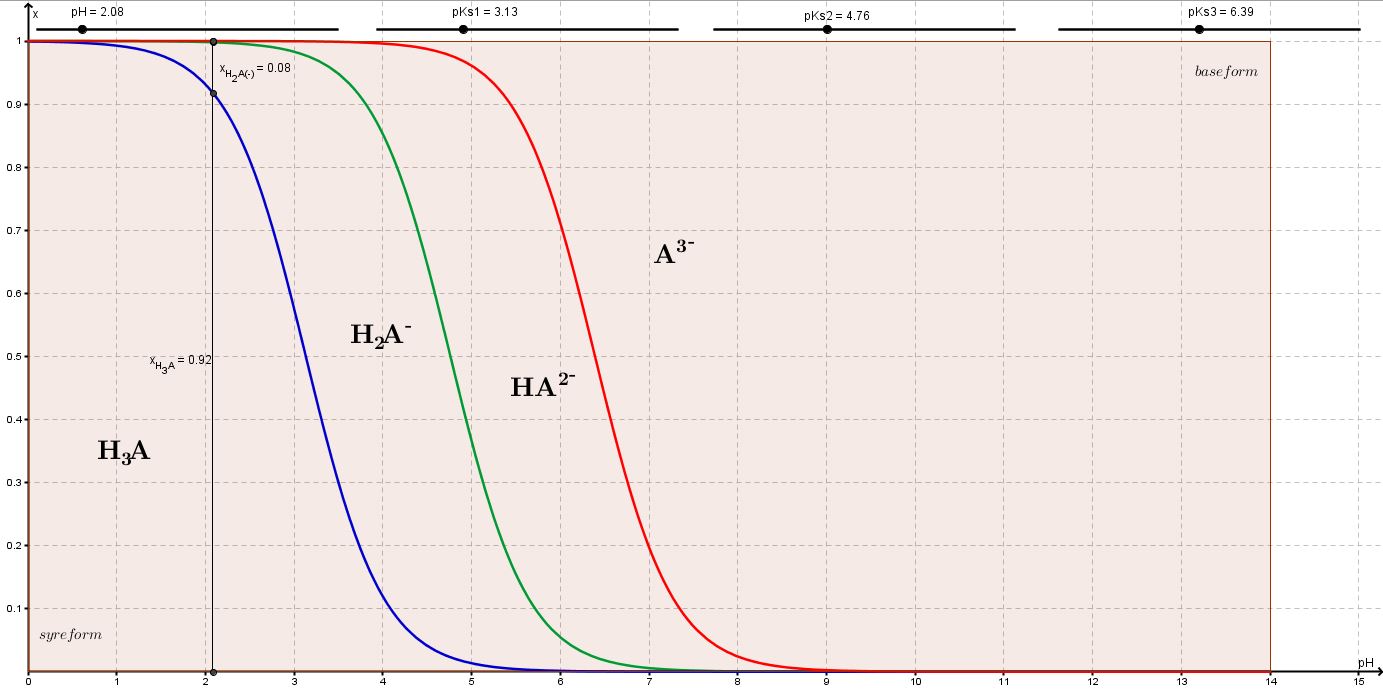
Det kan man næppe - men det er formentlig opgavestillerens mening - da pKs2 = 4,76 dvs af styrke som ethansyre.
Men et Bjerrumdiagram kan belyse forholdene.
Svar #6
01. november 2015 af Heptan
Jeg har regnet på det, det giver 2,08 for trihydron og 2,08 for monohydron. 3.13 er tilstrækkeligt mindre end 4,76 til at man kan se bort fra 2. og 3. hydronolysetrin.
Svar #7
01. november 2015 af bertel98
Vent, jeg er slet ikke med. Har i en indbyrdes diskussion nu?
At regne på hvad jeg forstod, så fik jeg Ph til at være 2.065.
1/2(3,13 - log(0,1)) = 2.065
Er det mig der er galt på den?
Svar #8
01. november 2015 af Heptan
#7
Hov, jeg gav dig den forkerte formel. Med en pKa-værdi under 4 er syren selvfølgelig middelstærk.

Fra http://www.e-formel.dk/view/pH-vaerdi-for-middelstaerk-syre
Svar #10
01. november 2015 af bertel98
Hmmm.. Jeg har lidt svært ved at afkode hvordan jeg skal bruge det i praksis. Kan du give et eksempel?
Svar #11
01. november 2015 af Heptan
#10
Du skal bare bruge den øverste formel. Jeg kopierede den fordi jeg har problemer med Latex (har I også det??)
Altså formlen pH = ...
hvor Ks = 10-pKa og c(s) = 0,1 M
Svar #13
01. november 2015 af mathon
#6
Du har regnet på det, og burde have fået pH = 2,88 for dihydron og pH = 2,08 for monohydron citronsyre.
Svar #16
01. november 2015 af Heptan
#13
Hvorfor skulle opløsningen blive mere basisk når syren er dihydron?
Svar #17
01. november 2015 af Heptan
Dihydron syre, pKa1 = 3,13 og pKa2 = 4,76.
Der ses bort fra vands egendissociation. Uden enheder og afrundinger.

Skriv et svar til: Udregning af Ph af fx. Citronsyre i en 0.1 M opløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.