Kemi
Beregn pH i en mættet vandig opløsning af Mn(OH)_2
22. september 2016 af
Eliasz
-
Niveau: A-niveau
Beregn pH i en mættet vandig opløsning af Mn(OH)_2. Opløselighedsproduktet for mangan(II)hydroxid er, K_sp(Mn(OH)_2)= 1.9*10^-13.
Nogle eksperter der kan hjælpe med denne opgave.
På forhånd tak!
Skriv et svar til: Beregn pH i en mættet vandig opløsning af Mn(OH)_2
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







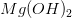 for
for 
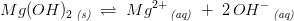
![\left [Mg^{2+}\right ]\cdot \left [OH^- \right ]^2=K_{sp}](https://media.studieportalen.dk/images/equations/Yvp0jxU7dspeQAivukjFXA==.gif)
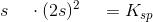
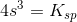
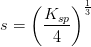
![\left [ OH^- \right ]=2s=2\cdot \left ( \frac{1{,}9\cdot 10^{-13}\; M^3}{4} \right )^{\frac{1}{3}}=7{,}2432\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/09uqRciKZf3Fawtk5cIISA==.gif)
![pH=14+\log\left ( \left [ OH^- \right ]/M \right )=14+\log(7{,}2432\cdot 10^{-5})=9{,}9](https://media.studieportalen.dk/images/equations/1lEHHJCWBy3Fpm4zf-z-9Q==.gif)