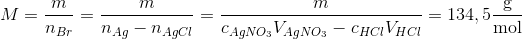Kemi
Analyse af ukendt stof - HJÆLP
Et rent stof findes ved kvalitativ analyse at indeholde følgende komponenter: jern og bromid.Der udføres en kvantitativ analyse for indholdet af de to komponenter.
a) Jernbestemmelse. Der afvejes 0,1604 g stof, som i en målekolbe opløses i 100,0 ml vand. Afdenne opløsning udtages 10,00 ml, som fortyndes med vand i en målekolbe til 500 ml. Vedatomabsorption finder man, at den sidste opløsning indeholder 4,47 mg jern per liter. Beregnstoffets molære masse på grundlag af jernanalysen.
Jeg får at M(stof) = 433 g/mol.
Men så får jeg problemer i den her opgave:
b) Bromidbestemmelse. Der afvejes 0,2901 g stof, som opløses i ca. 50 ml vand. Derpå tilsættes26,11 ml 0,1058 M AgNO3-opløsning, idet sølv(I)ionerne danner bundfald med bromid:Br– + Ag+ → AgBr(s)Den tilsatte stofmængde af sølv(I)ioner udgør mere end nødvendigt for at reagere med albromid, og derfor findes overskuddet af tilsat AgNO3 ved at titrere med HCl til ækvivalens-punktet: Cl– + Ag+ → AgCl(s)Ved ækvivalenspunktet er tilsat 5,44 ml 0,1112 M HCl.Beregn stoffets molære masse på grundlag af bromidanalysen.(HINT: forskellen mellem stofmængderne af tilsat AgNO3 og HCl svarer til den stofmængdeaf bromidioner, som befandt sig i det afvejede stof.)
Ved ikke hvordan jeg skal tackle denne opgave...
Skriv et svar til: Analyse af ukendt stof - HJÆLP
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.