Kemi
Hjælp med en opgave
Hej
Jeg skal fremstille 1,6 L 4,0 Mol/L 20 w/w % saltsyre. Hvor meger 20 w/w% saltsyre skal der afmåles ? er der nogen der kan hjælpe mig med at løse denne opgave og evt forklare den ?
på forhånd tak
Svar #1
23. juli 2017 af mathon
1,6 L 4,0 M HCl
udgør
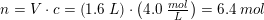
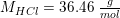
20w/w% HCl har densiteten 1.100 g/mL.
20w/w% HCl's molaritet
er:
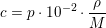
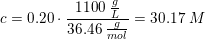 ?
?
Opgaven er nu
at skaffe 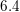 mol HCl af en
mol HCl af en 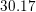 M HCl
M HCl
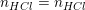
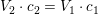
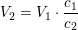
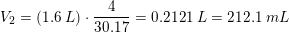
Konklusion:
Fremstilling af 1,6 L 4,0 M HCl af 20w/w% HCl
kan gøres ved
i en 2 L målekolbe at hælde lidt demineraliseret vand og derefter tilsætte 212 mL 20w/w% HCl under om røring efterfulgt af en fortynding til 1.6 L.
Svar #2
23. juli 2017 af mathon
detaljer:
omregning af masseprocent 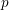 til molaritet
til molaritet  med kendskab til densiteten
med kendskab til densiteten 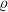 og molmassen
og molmassen 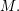
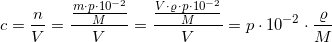
Svar #3
07. august 2017 af Meteora (Slettet)
#11,6 L 4,0 M HCl
udgør
20w/w% HCl har densiteten 1.100 g/mL.
20w/w% HCl's molaritet
er:
?
Opgaven er nu
at skaffemol HCl af en
M HCl
Konklusion:
Fremstilling af 1,6 L 4,0 M HCl af 20w/w% HCl
kan gøres ved
i en 2 L målekolbe at hælde lidt demineraliseret vand og derefter tilsætte 212 mL 20w/w% HCl under om røring efterfulgt af en fortynding til 1.6 L.
Hej Mathon. Din udregning er forkert og dermed dit svar. Der skal buges1060,65 ml af en 20 w/w % HCL opløsning (densitet 1,1 gram/ml) for at fremstille 1,6 liter HCL opløsning med koncentrationen 4 mol/ liter.
Svar #4
07. august 2017 af mathon
#1 redigeres foranlediget af årvågne #3
til:
1,6 L 4,0 M HCl
udgør
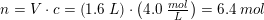
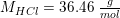
20w/w% HCl har densiteten 1.100 g/mL.
20w/w% HCl's molaritet
er:
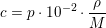
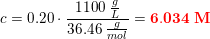
Opgaven er nu
at skaffe 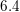 mol HCl af en
mol HCl af en 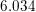 M HCl
M HCl
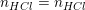
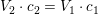
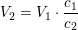
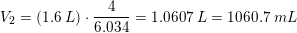
Konklusion:
Fremstilling af 1,6 L 4,0 M HCl af 20w/w% HCl
kan gøres ved
i en 2 L målekolbe at hælde lidt demineraliseret vand og derefter tilsætte 1060,7 mL 20w/w% HCl under
omrøring efterfulgt af en fortynding til 1600 mL.
Skriv et svar til: Hjælp med en opgave
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






