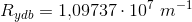Fysik
Energiniveaudiagram
Hej.
Nogen der kort kan fortælle mig hvad balmerserien, paschenserien og lymanserien betyder i sammenhæng med energiniveaudiagram?
Svar #1
20. februar 2016 af Soeffi
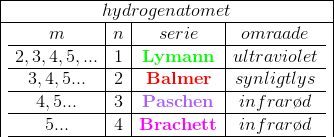
#0. Elektronen i et brintatom kan befinde sig forskellige energiniveauer. Normal vil den befinde sig på det laveste, der hedder n=1.
En elektron, der slås ud til et højere energinineau ved en påvirkning udefra, vil falde tilbage i retning mod lavere energiniveauer og udsende elektromagnestisk stråling. Jo længere elektronen falder, jo mere energi frigives og dermed jo kortere bølgelængde får den elekrtomagnetiake stråling, der udsendes.
Lymanserien (opdaget 1906-14) er de bølgelængder der opstår, når elektronen falder helt til nederste niveau. Disse eletromagnetiske stråler er ultraviolet lys.
Balmerserien (opdaget 1885) er de bølgelængder der opstår, når elektronen falder til næstlaveste niveau. Disse bølgelængeder giver synligt eller ultraviolet lys. Det forklarer, at Balmerserien var den første, der blev opdaget.
Paschenserien (opdaget 1908) er de bølgelængder, der opstår, når elektronen falder til tredjelaveste niveau. Bølgelængederne her giver infarødt lys.
Det skal bemærkes, at ingen at dem kunne give den ovennævnte forklaring, den kom først med Niels Bohr's atomteori i 1913.

Skriv et svar til: Energiniveaudiagram
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


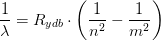
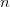 og
og 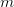 tallene
tallene 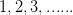 kan bølgelængden beregnes:
kan bølgelængden beregnes: