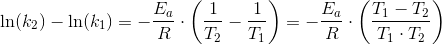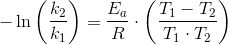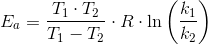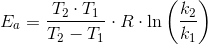Kemi
Beregning af aktiveringenergi
CH3COOC2H5(aq)+H^+(aq) --> CH3COOH(aq) + C2H5OH(aq)
Hastighedsudtrykket=k*[CH3COOC2H5]*[H^+]
Ved 25 C er k=4,51*10^-5 og ved 35 C er K= 1,09*10^-4 M^-1s^-1
Hvad er aktiveringsenergien ?
Jeg tror det har noget at gøre med Arrhenius man kan ikke lige gennemskue hvordan
Svar #1
14. september 2014 af LubDub
Det har netop noget med Arrhenius' ligning at gøre
k = A•e-Ea / R•T
ln(k) = ln(A•e-Ea / R•T) = ln(A) • (- Ea / R•T)
Heraf
ln(k1) = ln(A) • (- Ea / R•T1)
ln(k2) = ln(A) • (- Ea / R•T2)
Isoler selv Ea (to ligninger med to ubekendte)
Skriv et svar til: Beregning af aktiveringenergi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




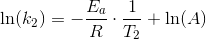
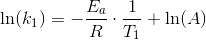 som ved subtraktion
som ved subtraktion