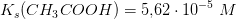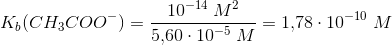Kemi
Syre- base ligevægtskonstant
Hej. Jeg har lavet opgave a og b men har brug for hjælp med c og d:
Eddikesyre, CH3COOH, er en monovalent, organisk syre. I vandig opløsning ved 25 oC har den syrestyrkekonstanten Ks = 5,62 · 10^–5 M.
a) Beregn pH i en 0,100 M vandig opløsning af eddikesyre.
b) Til 350 ml 0,0200 M opløsning af CH3COOH sættes 0,0200 mol fast natriumacetat, CH3COONa. Beregn pH i opløsningen, når det forudsættes, at blandingen forløber uden volumenforandring.
c) Der fremstilles en opløsning af 1,542 g ammoniumacetat, [CH3COO][NH4], i 1,00 l vand. Ammoniumionen, NH4+, er en svag syre med syrestyrkekonstanten Ks = 5,60 · 10^–10 M. Beregn ligevægtskonstanten K for den mest betydningsfulde ligevægt i opløsningen:
NH4++ CH3COO- <-->NH3 + CH3COOH
Molær masse (molvægt)/g·mol–1: [CH3COO][NH4] 77,08. Benyt endvidere data fra spørgsmål a.
d) Benyt K til beregning af koncentrationen af eddikesyre i opløsningen.
Svar #2
08. marts 2015 af chokolokolo (Slettet)
Men der står i a), at Ks for eddikesyren er 5,62*10^-5 M
Jeg kan beregne koncentrationen af ammonium og NH4, da deres forhold er 1:1 i stoffet ammoniumacetat. Jeg ved, at der afvejes 1,542 g i 1,00 L vand. n=m/M. n=1,542 g/77,08 g/mol=0.02000 mol.
C=n/V, C=0,02 mol/1 L= 0,0200 M.
Da forhold er 1:1 må konc af ammonium og acetat være 0,02 M. Ligevægtskonstanten ser sådan ud:
![K=\frac{[NH_{3}]*[CH_{3}COOH]}{[NH_{4}^{+}]*[CH_{3}COO^{-}]}](https://media.studieportalen.dk/images/equations/aRZLM2fGfa95LofgFpKt4w==.gif)
Jeg ved at i nævneren skal være stå 0,02*0,02. Men jeg er ikke helt klar over, hvad der skal stå i nævneren. Er jeg på rette spor?
Svar #3
08. marts 2015 af chokolokolo (Slettet)
ups. Jeg mente, at jeg ikke ved, hvad der skal stå i tælleren.
Svar #4
08. marts 2015 af mathon
a)
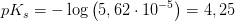 hvilket indikerer svag syre:
hvilket indikerer svag syre:
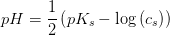
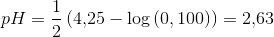
b)
Der foreligger en CH3COOH/CH3COO- puffer:
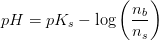
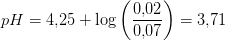
Svar #5
08. marts 2015 af mathon
c)
NH4+ (aq) + CH3COO- (aq) <--> NH3 (aq) + CH3COOH (aq)
molariteter: 0,02-x 0,02-x x x
ligevægtsbrøk:
![\frac{[NH_{3}]\cdot [CH_{3}COOH]}{[NH_{4}^{+}]\cdot [CH_{3}COO^{-}]}=](https://media.studieportalen.dk/images/equations/6CxPL7-VEnChmsy91_nKbg==.gif)
Svar #7
09. marts 2015 af chokolokolo (Slettet)
hvor kommer 1,78*10^-10 M fra? Opgave a siger, at ks for CH3COOH er 5,62*10^-5?
Skriv et svar til: Syre- base ligevægtskonstant
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










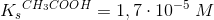
![\frac{\left [ NH_3 \right ]\cdot \left [ H_3O^+ \right ]}{\left [ N{H_{4}}^{+} \right ]}=5,60\cdot 10^{-10}\; M](https://media.studieportalen.dk/images/equations/9apL1O_bzMqkOnD5oST4uw==.gif)
![\frac{\left [ CH_3COOH \right ]\cdot \left [OH^- \right ]}{\left [ CH_3COO^- \right ]}=1,78\cdot 10^{-10}\; M](https://media.studieportalen.dk/images/equations/n2UfiE5xciKjvSqQt_T94Q==.gif) som ved multiplikation
som ved multiplikation![\frac{\left [ NH_3 \right ]\cdot \left [CH_3COOH \right ]}{\left [ N{H_{4}}^{+} \right ]\cdot \left [ CH_3COO^- \right ]}=10^{14}\cdot 5,60\cdot 10^{-10}\cdot 1,78\cdot 10^{-10}=9,97\cdot 10^{-6}](https://media.studieportalen.dk/images/equations/QiwYvDQ5skReeZHwvSr8Mg==.gif)
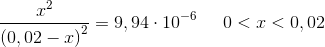
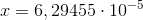
![\left [ CH_3COOH \right ]=x=6,29\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/LguMjhOUmKJeK2GCQJrp3g==.gif)