Fysik
HJÆÆÆLP
Nogen der kan hjælpe mig med en opgave, som jeg har prøvet at knække i nogle timer uden held.
En beholder indeholder 100 kg af en fortyndet vandig opløsning, som antages at have samme fysiske egenskaber som rent vand. Opløsningen er i åben forbindelse med omgivelserne med et tryk på 1,00 atm og temperaturen 20C. Opløsningen skal opvarmes til 60C. Dette gøres ved at lede mættet vanddamp ved 100C til opløsningen. Al den tilledte vanddamp kondenseres og forbliver i opløsningen.
a) Beregn hvor mange kg vanddamp, der skal tilledes for at opvarme opløsningen til 60?C, under forudsætning af, at beholderen er af et isolerende materiale, som hverken optager varme fra indholdet eller udveksler varme med omgivelserne.
b) Beregn den samlede entropiændring ved blandingen af den vandige opløsning og vanddampen. Er blandingen en naturligt forløbende proces?
c) Beregn hvor mange ekstra kg damp, der skal anvendes, hvis beholderen i stedet består af 13 kg aluminium, som sammen med opløsningen opvarmes til 60?C. Aluminiumsbeholderen er isoleret på ydersiden og afgiver ikke varme til omgivelserne
Svar #1
24. april 2015 af Heptan
a)
Da systemets samlede energi er konstant (da systemet er varmeisoleret og intet arbejde udføres), er
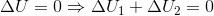
Hvor 1 henviser til vandet med temperaturen 20 grader og 2 vandet med temperaturen 100 grader.
Al den indre energi kommer af varme, og ikke arbejde. Det kan vi udnytte til at benytte formlen:
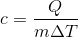
og opstille ligningerne
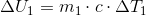
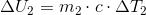
som indsættes i den første ligning:
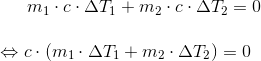
hvor c er vands specifikke varmekapacitet, m1 = 100 kg, ΔT1 = 60 ºC - 20 ºC, ΔT2 = 60 ºC - 100 ºC, og m2 er den ubekendte masse af vanddamp.
Isolér m2.
Svar #2
24. april 2015 af peter lind
Tilført energi til den vandige opløsning
Q = m*c*ΔT m masse af opløsning c specifik varmekapacitet for vand ΔT temperaturstigning
Afgivet energi fra damp
Q = md*L + md*c*ΔTd md masse af damp. L damps specifikke fortætningsvarme, ΔTd temperaturfaldet af dampen
Svar #3
24. april 2015 af Heptan
Nårh ja, jeg glemte fortætningen.
I forlængelse #1 fås altså varmebidraget
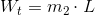
som giver
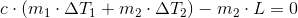
hvor L er den specifikke fordampningsvarme af vand.
Svar #4
24. april 2015 af madshenriksen (Slettet)
jeg får resultatet til at give 100 kg vanddamp, MEN resultatet er
a) m2=6,9 kg vanddamp
Svar #5
24. april 2015 af madshenriksen (Slettet)
Har fået det rigtige resultat nu, takket være Svar #3
Svar #6
24. april 2015 af Heptan
b) Beregn den samlede entropiændring ved blandingen af den vandige opløsning og vanddampen. Er blandingen en naturligt forløbende proces?
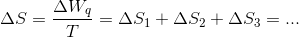
Hvordan beregner man entropitilvæksten for en fortætning? Den må være negativ...
Svar #7
24. april 2015 af madshenriksen (Slettet)
svaret på opgvave b) er
8,5 kJ/K > 0, dvs. naturligt forekommende proces
Svar #8
24. april 2015 af Heptan
c) Beregn hvor mange ekstra kg damp, der skal anvendes, hvis beholderen i stedet består af 13 kg aluminium, som sammen med opløsningen opvarmes til 60?C. Aluminiumsbeholderen er isoleret på ydersiden og afgiver ikke varme til omgivelserne
Sammenlignet med a) har vi nu også bidraget
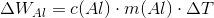
Dvs. vi får
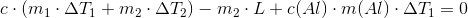
Svar #9
23. maj 2015 af bento94 (Slettet)
Blev entropiændringen (spørgsmål b) nogensinde beregnet? Jeg kan ikke få den til at give det rigtige resultat
Skriv et svar til: HJÆÆÆLP
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

