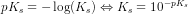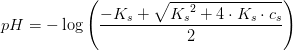Kemi
Beregning af ph i syreopløsninger
02. februar 2017 af
Theguyfromskive
-
Niveau: 10. klasse
Jeg forstår ikke helt hvordan man beregner ph i en syreopløsning er der nogen der kan forklare og give et eksempel med Tak på forhånd
Skriv et svar til: Beregning af ph i syreopløsninger
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




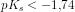
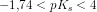
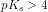
![\left [ H_3O^+ \right ]=c_s](https://media.studieportalen.dk/images/equations/X-q6iWakR7-vk393af5IKg==.gif)
![-\log\left (\left [ H_3O^+ \right ] /M \right )=-\log\left (c_s/M \right)](https://media.studieportalen.dk/images/equations/76yMv8QQrL4sYV_zT63vUg==.gif)
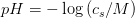
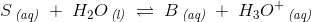
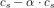
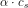
![\frac{\left [ B \right ]\cdot \left [H_3O^+ \right ]}{\left [ S \right ]}=K_s](https://media.studieportalen.dk/images/equations/ztI-QsLR4G3jjHPRcBbe2Q==.gif)
![\frac{ \left [H_3O^+ \right ]^2}{c_s-\left [H_3O^+ \right ]}=K_s\; \; \; \; \; \; 0<\left [H_3O^+ \right ]<c_s](https://media.studieportalen.dk/images/equations/rcnegrjnfHNEiatZlGwflw==.gif)
![\left [H_3O^+ \right ]=\frac{-K_s+\sqrt{{K_s}^2+4K_s\cdot C_s}}{2}\; M](https://media.studieportalen.dk/images/equations/MRENHeRHZECXhTesFGcw1g==.gif)
![\underset{\alpha <<0{,}5}{\lim} \left (c_s-\left [ H_3O+ \right ] \right )=c_s](https://media.studieportalen.dk/images/equations/p7kuSlPCmeadAMUcK2N2NQ==.gif)
![\frac{ \left [H_3O^+ \right ]^2}{c_s}=K_s\; \; \; \; \; \; 0<\left [H_3O^+ \right ]<c_s](https://media.studieportalen.dk/images/equations/SfCKJ_E9R6o2Ws7rNQz7Vw==.gif)
![\left [H_3O^+ \right ]^2=K_s\cdot c_s](https://media.studieportalen.dk/images/equations/jKPyy0zzNV7QmZEm04E_tw==.gif)
![\left [H_3O^+ \right ]=\left (K_s\cdot c_s \right )^{\frac{1}{2}}](https://media.studieportalen.dk/images/equations/KqyXfJ-soC0x3e096JKLNA==.gif)
![\log \left (\left [H_3O^+ \right ] \right )=\tfrac{1}{2}\left (\log\left (K_s \right )+ \log\left (c_s \right ) \right )](https://media.studieportalen.dk/images/equations/nY6N4qInSmcDmxaliRv7xg==.gif)
![-\log \left (\left [H_3O^+ \right ] \right )=\tfrac{1}{2}\left (-\log\left (K_s \right )- \log\left (c_s \right ) \right )](https://media.studieportalen.dk/images/equations/2qw8kBdyVLWPgJqqRiRhog==.gif)
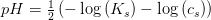
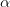 er dissociationsgraden og
er dissociationsgraden og