Kemi
pH
100 ml af en 0.100 M opløsning af NH3 (kb =1,8*10-5 ) titreres med 0.200 M HNO3.
Beregn pH af opløsningen efter tilsætning af følgende mængder syre:
f) 50 ml
g) 100 ml
Er der nogen der kan hjælpe med denne opgave?
Svar #1
03. januar 2015 af Heptan
Ved tilsætning af 50 mL 0,200 M stærk syre er der netop lige store mængder ammoniak og stærk syre. Dette er derfor ækvivalenspunktet, og pH kan beregnes, da ammonium er ladt tilbage.
Svag syre, rimelig koncentration:
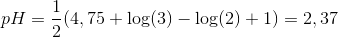
![[H_3O^+]=10^{-2,37}=0,004266\ \textup{M}](https://media.studieportalen.dk/images/equations/CMrZZS5xVQ1_iPBUnnySHg==.gif)
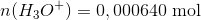
Efter tilsætning af yderligere 50 mL 0,200 M (0,01 mol) stærk syre fås en pH værdi på
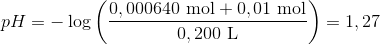
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

