Kemi
hjælp
For hydrogensulfat, HSO4
−, er syrekonstanten Ka = 1,02·10−2.
Beregn herudfra pH i en 0,050 M opløsning af NaHSO4
Svar #1
28. oktober 2014 af OliverGlue
(Alternativt, sandsynligvis dit pensum?, kan formlen for en middelstærk syre benyttes fra http://homepage.svendborg-gym.dk/rk/kemi/formelsamling/formelsamling%20syrer%20og%20baser.htm)
pH=-log10(-1.02*10^(-2)*(1/2)+sqrt(1.02*10^(-4)*(1/4)+1.02*10^(-2)*0.50e-1))=1.74
Hydrogensulfat dissocierer i vand ved følgende ligevægt
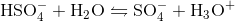
Ligevægtskonstanten er givet ved
![K_{\mathrm{a}}\mathrm{=}\dfrac{[\mathrm{SO_{4}^{-}][H_{3}O^{+}}]}{[\mathrm{HSO_{4}^{-}]}}](https://media.studieportalen.dk/images/equations/GWP8Igub3A2KOZVqG3RiGA==.gif)
Når hydrogensulfat dissocierer, dannes x sulfat og x hydronium, derved kan ligevægtsbrøken opskrives til
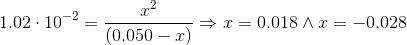
Hvor koncentrationen skal være positiv, derfor
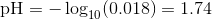
Skriv et svar til: hjælp
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

