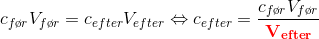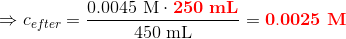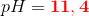Kemi
pH
Jeg er lidt i tvivl mht. pH i opløsninger.
Hvis en opgave lyder: Beregn pH i opløsningen: 0,025 M HNO3
- skal jeg så ikke bruge formlen: pH = - log [H+] ??? idet HNO3 er en stærk syre
- således at resultatet bliver: pH = - log (1 × 0,025) = 1,6 ???
Hvad så hvis jeg har en anden opgaver: Beregn pH i opløsningen: 250 mL 0,0045 M KOH og 200 mL dem. vand
- skal jeg så tage hensyn til vandet?!?!?!?!
Svar #1
04. januar 2015 af OliverGlue
Svar #2
04. januar 2015 af Solvejens
Det har jeg ikke lært, hvordan man gør. Kan du gøre det for mig?
Svar #3
04. januar 2015 af OliverGlue
#2:
Før en fortydning har du en stofmængde givet ved
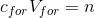
efter fortydningen har du en stofmængde givet ved
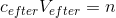
i en fortydning er stofmængden konstant, hvormed disse to ligninger kan sættes lig hinanden
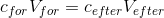
også kendt som fortyndingsformlen.
Til at benytte den skal du altså kende 3 af de ubekendte størrelser, i dette tilfælde kender du start volume, start koncentration og slut volume, det giver
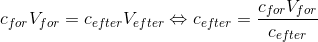
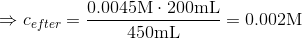
pH findes ud fra pOH af hydroxid ionerne
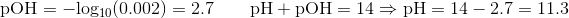
Svar #4
04. januar 2015 af mathon
#2
Voluminet øges fra 250 mL til 450 mL det vil sige med faktor 1,8.
pH i opløsningen: 250 mL 0,0045 M KOH og 200 mL dem. vand
![\small \left [ OH^- \right ]=\frac{0,0045\; M}{1,8}=0,0025\; M](https://media.studieportalen.dk/images/equations/1i2BMI2-P3OY8UQ0OOC6Ig==.gif)
![\small pH=14-pOH=14+\log\left ( \left [ OH^- \right ] \right )=14+\log(0,0025)=11,40](https://media.studieportalen.dk/images/equations/6UwffubrQfVT0XucVfQfUw==.gif)
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.