Isotop
En isotop er et grundstof af en bestemt variant. Hvert atom har et atomnummer, som siger hvor mange protoner atomkernen indeholder, men antallet af neutroner i kernen kan variere. For hver variation af et atom har vi en isotop.
For eksempel har brint en proton og ingen neutroner. Men brint har også en isotop, som vi kalder deutorium, som har en proton og en neutron. Antallet af protoner er det samme, men antallet af neutroner er forskelligt.
Isotoper er altså varianter af samme grundstof. Det betyder, at nogle af deres egenskaber er de samme, og ofte vil de indgå i de samme kemiske forbindelser og reaktioner. Men nogle egenskaber er også anderledes. Flere eller færre neutroner betyder en forskel i vægt, og i mange tilfælde vil nogle af et grundstofs isotoper være ustabile. De vil altså henfalde på et tidspunkt.
Isotop kommer fra græsk og betyder samme plads, fordi hver isotop har samme plads i det periodiske system. Vi identificerer isotoper ved hjælp af massenummeret, som vi skriver øverst til venstre for grundstoffet.
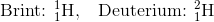
Det øverste tal foran grundstoffet er det samlede antal nukleoner, altså både protoner og neutroner, og det nederste er antal protoner, som altid vil være det samme for alle et grundstofs isotoper.
Nogle gange, når der ikke er tale om et reaktionsskema, bruger man også notationen: grundstof-massenummer. For eksempel kulstof-14, som er kulstof isotopen med massenummer 14. Her skriver man altså bare grundstoffets fulde navn og dets massenummer bagefter, for at indikere hvilken isotop det er.
En vigtig egenskab ved et grundstofs forskellige isotoper er, som tidligere nævnt, at de i de fleste tilfælde kan indgå i de samme kemiske forbindelser. Kemiske forbindelser styres i højgrad af grundstoffernes elektromagnetiske egenskaber, og da neutroner ikke har nogen ladning påvirker de ikke elektromagnetiske reaktioner.
Sagt på en anden måde, antallet af elektroner i et atom bestemmes af kernens positive ladning, som bestemmes af antal protoner. Neutroner giver ikke større eller mindre ladning, så de vil ikke påvirke elektroner. Og det er elektronerne i atomer, der skaber de kemiske forbindelser.
På grund af deres vægt, vil isotoper med højere antal af neutroner dog ofte reagere lidt mere langsomt end de lettere isotoper.
På den anden side, hvis man ser på isotoper fra en fysisk synsvinkel, er der vigtige forskelle. For en atomkerne betyder en forskel i antal neutroner i de fleste tilfælde en forskel i stabilitet. Der skal være de rigtige antal neutroner, ellers vil kernen henfalde.
Det skyldes at den stærke kernekraft, som holder kerner sammen, også har en modsat effekt. Hvis kerner bliver for tunge, og protoner og neutroner bliver presset for meget sammen, vil den stærke kernekraft begynde at skubbe dem fra hinanden. Denne ubalance afhjælpes ved at udsende energi i form at radioaktiv stråling.
Man bruger denne egenskab, at forskellige isotoper kan bruges i de samme kemiske forbindelser, i en række teknologier og forsøg. Et eksempel er såkaldt tungt vand. Tungt vand består af tungere brint isotoper forbundet med ilt. Brint har de to tunge isotoper deutorium (D) og tritium (T). Deutorium består af én proton og én neutron, og trititum består af én proton og to neutroner.
Tungt vand bruges blandt andet i nogle kernereaktorer, hvor det bremser neutroner fra kernereaktionerne.
Forskellige isotoper af et grundstof kan identificeres ved hjælp af massespektrometri. Massespektrometri er en analysemetode, som deler molekyler op efter masse. Analysen foretages med et såkaldt massespektrometer. Hvis man foretager massespektrometri på de samme molekyler, og der er isotopforskelle, vil man altså kunne se dem ved, at molekyler med forbindelser til tungere isotoper vil have højere masse. Således kan man altså identificere isotoper.
Ved at tilføje radioaktive isotoper til molekyler i biologiske forbindelser, kan det gøres muligt at følge biologiske processer meget præcist. Ved at måles på den radioaktive stråling kan disse molekyler dermed blive lokaliseret og identificeret, og man kan følge hvordan biologiske processer foregår. Dette har mange anvendelsesmuligheder fra biologisk og kemisk grundforskning til livsvigtige medicinske undersøgelser.
Isotopkort
Et isotopkort er en udvidning af det periodiske system, hvor man viser alle de kendte isotoper af hvert grundstof. Ofte vil man også angive nogle af de egenskaber, som adskiller isotoperne. Et isotopkort kan også kaldes en isotoptabel eller et isotop skema.
Isotoptabel. I gitteret har vi antal protoner (p) henad og antal neutroner (n) nedad. De kendte isotoper skrevet ind med deres grundstof navn. Isotoperne med blå baggrund er stabile, og isotoperne med hvid baggrund er ustabile og altså radioaktive.
Isotoptabellen udvides hele tiden, når man opdager nye isotoper. Mange af de isotoper, vi har i tabellen, er skabt i laboratoriet og vil i langt de fleste tilfælde henfalde efter meget kort tid.
Mange isotopkort vil også vise hvilken form for henfald ustabile isotoper har.


