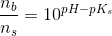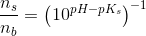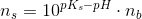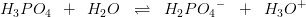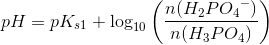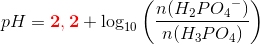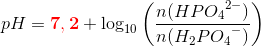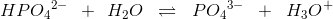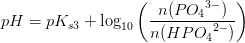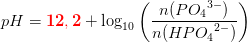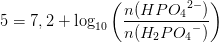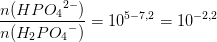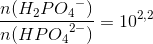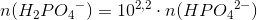Kemi
Ligning og buffer
Hej
jeg ka simpelthen ikke komme vidre med det her.
pH =pKs+ log 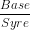
Hvis både pH er kendt og base er kendt hvordan finder jeg så det ubekendte ?
Svar #3
06. december 2014 af Heptan
#1
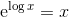
er forkert. Man kan ikke blande titalslogaritmer og naturlige på den måde.
_________________________________________________________________
#0
Benyt at
![\log \left ( \frac{[B]}{[S]} \right ) = \log [B] -\log [S]](https://media.studieportalen.dk/images/equations/AYIoe00qB1CsE6U1iw-8PA==.gif)
og
![\log [S] =x \newline \Leftrightarrow [S] = 10^x](https://media.studieportalen.dk/images/equations/X6dWXna_eDoU8LOLFg0eAw==.gif)
Svar #4
07. december 2014 af thelight
Nu er jeg forvirret for at være ærlig.
Så hvis f.eks. pH = 5 og konc for syre = 4 mmol/L
så indsætter jeg
5= pKs + log 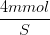
5= pKs + log [4] - log [S]
5= pKs + log [4] - x
5= pKs + log [4] - 10x
hvad sker der så?
Svar #5
07. december 2014 af thelight
Jeg mener desuden at pKs skal slås op....men er det pKs for base eller syre jeg ska finde?
Svar #6
07. december 2014 af Therk
Jeg beklager. Jeg skrev naturligvis under antagelsen at
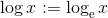
som nogle steder skrives
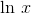 .
.
Svar #8
07. december 2014 af thelight
men den ligning som er den sidste
![[S]=10^{pKs-pH} [B]](https://media.studieportalen.dk/images/equations/dCYkuRddGChKH5qnDixn1w==.gif)
Hvis jeg sætter ind i den så bliver det jo
[S]=10pKs-5 [4]
Jeg mangler jo stadig at vide hvad jeg skal indsætte på pKs's plads for at finde [S]?
Svar #9
07. december 2014 af Heptan
#5 Det er ligemeget, det er den samme værdi.
Medmindre det er en polyprot eller amfiprot syre.
#8 Som du selv siger, så er det en tabelværdi.
Svar #10
07. december 2014 af thelight
hvad mener du med samme værdi? så hvad skal jeg taste ind på pKs's plads ?
Det er bare sådan at jeg skal ende med at finde den ubekendte....men her er det jo både syre og pKs jeg ikke kender
Svar #12
07. december 2014 af thelight
pKs er for syren, men når nu jeg ikke har fundet syrens koncentration?
Svar #14
07. december 2014 af Heptan
#10
Hvis du skal finde den ubekendte, så må der jo være en af de to værdier du allerede kender, men som du måske ikke har bemærket?
Svar #15
07. december 2014 af thelight
Jeg tror det bør være pKs værdien jeg ikke har bemærket men som jeg burde kende...da syren er kendt og basen bør derfor være ubekendt....men jeg forstår godt hvad det er i alle siger med at
ns=10pKs-pH  nb
nb
Jeg kender nb og jeg kender pH
pH = 5 og nb = 4 mmol/L
ns er jo fint isoleret og burde være til at finde...men hvordan i alverden finder jeg den når jeg ikke ved hvad jeg skal taste ind på højre side for en pKs værdi? Jeg er også godt med på at jeg skal slå den op....men er det pKs værdien for basen eller syren jeg skal slå op??
Svar #16
07. december 2014 af Heptan
Som jeg sagde, så er det ligemeget, da det er den samme værdi.
Hvis du prøvede at slå dem op, så ville du måske opdage det?
Skriv et svar til: Ligning og buffer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





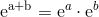 og
og 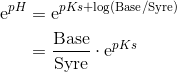
![pH=pKs+\log_{10}\left ( \frac{\left [ B \right ]}{\left [ S \right ]} \right )](https://media.studieportalen.dk/images/equations/0GLC0Ao_mWxZL3X87ALDZw==.gif)
![\frac{\left [ B \right ]}{\left [ S \right ]}=10^{pH-pK_s}](https://media.studieportalen.dk/images/equations/YPeSudHs4yqHwObIJPB6NQ==.gif)
![\frac{\left [ S \right ]}{\left [ B \right ]}=\left (10^{pH-pK_s} \right )^{-1}](https://media.studieportalen.dk/images/equations/ebaPmnYGwXWqzKGFbkjkZA==.gif)
![\left [ S \right ]=10^{pK_s-pH}\cdot \left [ B \right ]](https://media.studieportalen.dk/images/equations/3r8IIzaQm77eHaSBaGTzuw==.gif)
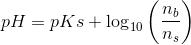 da voluminet er ens/fælles
da voluminet er ens/fælles