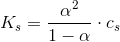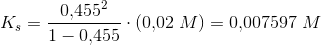Kemi
PH beregning for ukendt syre
Hej
Jeg sidder og kæmperemd en opgave. Er der nogen der kan hjælpe med følgende:
Hydronolysegraden i % blev bestemt til 45,5 % for en 0,02 M opløsning af en ukendt syre.
1: beregn de aktuelle koncentrationer af oxoniumioner og hydroxidioner og derpå PH og POH.
2: Beregn styrkekonstanten og styrkeeksponenten for syren.
Svar #3
25. september 2015 af indianeren
Jeg husker sammenhængen men hvordan finder jeg pKs? eller for den sags skyld cs ?
Svar #4
25. september 2015 af indianeren
Nu har jeg isoleret ks i formlen: cs•α2 + ks•α - ks = 0
og får
solve(0.02*(0.45)^(2)+ks*0.45-ks=0,ks) ? ks=0.007364
er dette korrekt?
Skriv et svar til: PH beregning for ukendt syre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





![\left [ H_3O^+ \right ]=\alpha \cdot c_s=0{,}455\cdot (0{,}02\; M)=9{,}1\cdot 10^{-3}\; M](https://media.studieportalen.dk/images/equations/fSPlpW8FzMRPnvJKTtBE4g==.gif)
![\left [ OH^- \right ]=\frac{10^{-14}\; M^2}{\left [ H_3O^+ \right ]}](https://media.studieportalen.dk/images/equations/JrwYaJ24jAYnmxBTn0V4IQ==.gif)
![pH=-\log\left ( \left [ H_3O^+ \right ] \right )](https://media.studieportalen.dk/images/equations/ygUgGrU0kufaJLSQmxzyBg==.gif)
![pOH=-\log\left ( \left [ OH^- \right ] \right )](https://media.studieportalen.dk/images/equations/LJlCC1o2KPWT-J0-hvsPZA==.gif)
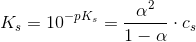 ?
?