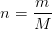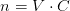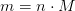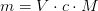Kemi
mængdeberegninger
Heeej :)
Jeg har et eksamensspørgsmål om mængdeberegninger. Kan noget forklare mig hvad 1 mol er, og hvad formelmassen er, samt hvorfor disse to begreber er vigtige ifht. formlen m = M*n ?
Jeg forstår det sådan her:
1 mol = 6,02 * 1023 er en enhed, som angiver et antal. (men et antal hvad? atomer?)
En formelmasse er summen af atommasserne for de stoffer, som indfår i reaktionen, og angives i unit. Og et atom vejer altså det samme i unit, som 1 mol af det samme salgs atomer gør i gram. På den måde kan man altså oversætte et antal (et mol) til en vægt (en masse)
Men hvordan bruges det så i forhold til formlen?
formlen angiver sammenhængen mellem et stofs molarmasse, masse og stofmængde. Så hvis man f.eks. kender stoffets masse, altså vægt, kan man beregne den molaremasse, og herved fine stofmængden, altså, hvor mange mol af et stof, skal der til at får reaktionen til at forløbe?
Er det korrekt, mangler jeg at uddybe noget, eller er det helt forkert?
Svar #1
03. august 2016 af mathon
Definition af en atommasseenhed
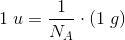
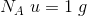
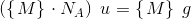
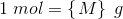
6,02214 * 1023 er et ANTAL = det antal (atomer), som 12,00 g 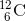 indeholder.
indeholder.
Svar #2
03. august 2016 af mathon
korrektion:
Definition af en atommasseenhed
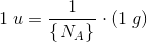
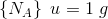
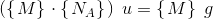
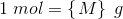
6,02214 * 1023 er et ANTAL = det antal (atomer), som 12,00 g 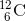 indeholder.
indeholder.
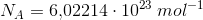
hvor
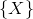 betyder talværdien af størrelsen
betyder talværdien af størrelsen 
Svar #4
03. august 2016 af Manu0407 (Slettet)
Hold da op, det synes jeg godt nok er kompliceret. Kan slet ikke huske, at det blev gennemgået så uddybbende i undervisnignen. Men tak! :) prøver lige at læse lidt videre på det!
Kan jeg måske få dig til at forklare mig, hvordan de to formler
m = M*n og N=C*V hænger sammen ? :)
Svar #5
03. august 2016 af Manu0407 (Slettet)
er m = M*n mængdeberegning for stoffer i fast form, N=C*V er mængdeberegning i flydende, og idealgasloven til gasser?
Skriv et svar til: mængdeberegninger
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.