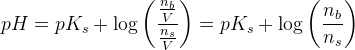Kemi
pH
Hej
Jeg har prøvet at løse nedenstående opgave men jeg kan ikke finde ud af det. Mine løsninger er ikke ligesom facit:1) 4,30 2) 7,00 3) 6,99 4) er uændret. 5) 6,90 6) 12,50
Opgaven:
For en vandig opløsning af diverse ioner gælder med god tilnærmelse at 1 mL = 20 dråber.
Til 1 dL rent vand tilsættes 1 dråbe 0,1 M opløsning.
1) Hvad bliver pH?
2) I en given phosphatbuffer er ]= 6,2 mM og =3,8 mM . Hvad er pH i
denne buffer?
3) Der tilsættes 1 dråbe 0,1 M HCl opløsning til 1 dL af bufferopløsningen. Hvad bliver
pH?
4) Hvad bliver pH hvis bufferopløsningen fortyndes 10 gange?
5) Hvad bliver pH hvis der til 1 dL af den fortyndede opløsning tilsættes 1 dråbe 0,1 M HCl
opløsning.
6) Hvad bliver pH hvis vi til 1 dL af Ba(OH)2-opløsningen i opg. 1.1 tilsætter 1 dråbe
0,1 M HCl?
Svar #1
10. september 2016 af mathon
1)
Til 1 dL rent vand tilsættes 1 dråbe 0,1 M opløsning af hvad?
Svar #3
10. september 2016 af Phoenix4
Glemte at skrive opgave 1.1 ind:
Opgave 1.1
En Ba(OH)2-opløsning har pH 12,50.
1) Beregn [Ba+] og [oh-] i M
2) Hvad bliver pH hvis opløsningen fortyndes 10 gange?
Svar #4
10. september 2016 af mathon
1)
1 dråbe = 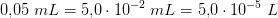
1 dråbe 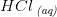 indeholder
indeholder 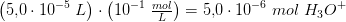
blandingskoncentration:
![\left [ H_3O^+ \right ]=\frac{5{,}0\cdot 10^{-6}\; mol}{10^{-1}\;L}=5{,}0\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/pTWO4b_1Z7WcPGyRnygypw==.gif) da volimen ikke lndres kendeligt fra 1 dL
da volimen ikke lndres kendeligt fra 1 dL
![pH=-\log\left (\left [ H_3O^+ \right ]/M \right )=-\log\left (5{,}0\cdot 10^{-5} \right )=4{,}30](https://media.studieportalen.dk/images/equations/SvZm-mGpl2TwnBzrrpf8dg==.gif)
Svar #5
10. september 2016 af mathon
2) I en given phosphatbuffer er [? ]= 6,2 mM og ?? = 3,8 mM . Hvad er pH i
denne buffer?
Svar #6
10. september 2016 af Phoenix4
Det må du undskylde der er (H2PO4 og minus op i hjørnet) og HPO4 og 2- oppe i hjørnet
Svar #7
10. september 2016 af mathon
2) I en given phosphatbuffer er ![\left [ H_2P{O_4}^{-} \right ] \; 6{,}2\; mM](https://media.studieportalen.dk/images/equations/ZfzlORbDTeYOHIhj0Uo48w==.gif) og
og ![\left [ HP{O_4}^{2-} \right ] \; 3{,}8\; mM](https://media.studieportalen.dk/images/equations/FKIEAMdzwugYXmSDN74Egg==.gif) . Hvad er pH i
. Hvad er pH i
denne buffer?
pufferligningen
giver:
![pH=pK_s+\log\left ( \frac{\left [ B \right ]}{\left [ S \right ]} \right )](https://media.studieportalen.dk/images/equations/uTy1JK3u1QMp-SmWXrHjug==.gif)
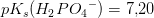
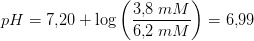
Svar #10
10. september 2016 af mathon
5)
I den givne phosphatbuffer er nu ![\left [ H_2P{O_4}^{-} \right ] \; 0{,}62\; mM](https://media.studieportalen.dk/images/equations/IEVbUFNqp997Z9T93qTdpA==.gif) og
og ![\left [ HP{O_4}^{2-} \right ] \; 0{,}38\; mM](https://media.studieportalen.dk/images/equations/lmQDGqNkZ9Rp731GJjgFmA==.gif) . Hvad er pH i
. Hvad er pH i
denne buffer, hvs der tilsættes 1 dråbe 0,1 M HCl (aq)?
1 dL = 100 mL af denne pufferopløsning indeholder før tilsætningen
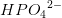
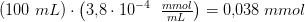
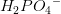
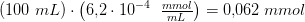
efter tilsætning af 1 dråbe 0,1 M HCl (aq)
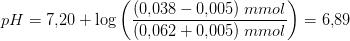
Svar #15
10. september 2016 af mathon
6)
Opgave 1.1
En Ba(OH)2-opløsning har pH 12,50.
Til 1 dL af denne tilsættes 1 dråbe 0,1 M HCl-opløsning.
hvad bliver pH?
![\left [ OH^- \right ]=0{,}031623\; M](https://media.studieportalen.dk/images/equations/_3y1ggw_wtxgx7OoyjUOHQ==.gif)
1 dL indeholder:
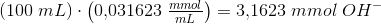
ved tilsætning af 1 dråbe HCl-opløsning
mindskes antallet af mmol OH- med 0,005 mmol
hvoraf
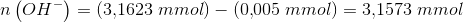
som i 100 mL har den aktuelle koncentration:
![\left [ OH^- \right ]=\frac{3{,}1573\; mmol}{100\; mL}=0{,}031573\; \tfrac{mmol}{mL}=0{,}031573\;M](https://media.studieportalen.dk/images/equations/p9Vs1dcUsKZx9-hqDLx82g==.gif)
![pH=14+\log\left ( \left [ OH^- \right ]/M \right )=12{,}499](https://media.studieportalen.dk/images/equations/4wCn_bnYA8bRMF97ipa4uQ==.gif)
Svar #17
11. september 2016 af Phoenix4
I spørgsmål 3) bruger du mol i stedet for M for HCl der bliver tilført til buffere; hvorfor må man det?


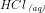 indeholder
indeholder 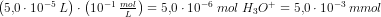
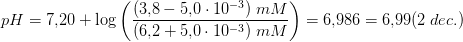
![\frac{\left [ B \right ]}{\left [ S \right ]}](https://media.studieportalen.dk/images/equations/n9a3e2iADgifXORQc5g55g==.gif) ændres ikke hvorfor
ændres ikke hvorfor![pH=14+\log(\left [ OH^- \right ]/M)](https://media.studieportalen.dk/images/equations/aGiQiQh3eykShJZgtT27EA==.gif)
![pH-14=\log(\left [ OH^- \right ]/M)](https://media.studieportalen.dk/images/equations/yw3NYbwUWZ4KFXPg24Rpug==.gif)
![10^{\, pH-14}=\left [ OH^- \right ]](https://media.studieportalen.dk/images/equations/WVs7-b-93_HRnjO0DsAVeQ==.gif)
![\left [ OH^- \right ]=10^{\, 12{,}5-14}=0{,}031623\; M](https://media.studieportalen.dk/images/equations/YM5qH3K6D6_XohJJ6a4zxA==.gif)
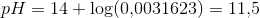
![pH=pK_s+\log\left ( \frac{\left [ B \right ]}{\left [ S \right ]} \right )](https://media.studieportalen.dk/images/equations/DXl8wkZMUYpfFza6AeO9gg==.gif)