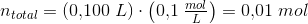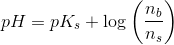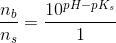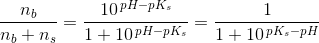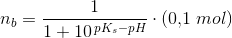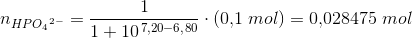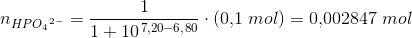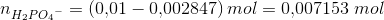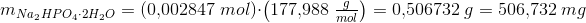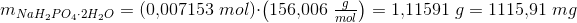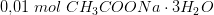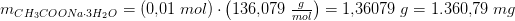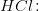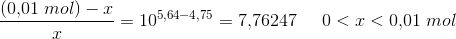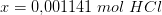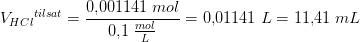Kemi
pH og buffersystemer
1) Der skal fremstilles 100 mL acetatbuffer med pH = 6,80 og en totalkonc. af pufferen på 0,1 M.
Jeg skal beregne, hvor meget Na2HPO4 · 2H2O og NaH2PO4 · 2H2O, der skal afvejes.
Her behøver jeg hjælp.
2) Der skal fremstilles 100 mL af en puffer med en konc. på 0,1 M.
Jeg skal beregne, hvor meget CH3COONa · 3H2O, der skal afvejes.
Er dette korrekt: Mnatriumacetat = (0,10 mol/L * 100 mL * 82,03 g/mol) / (1000 mL/L) = 0,8203 g ?
Derudover skal jeg beregne, hvilket volumen 0,1 M HCl, der skal tilsættes for at få pH = 5,64.
Her behøver jeg hjælp.
Skriv et svar til: pH og buffersystemer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.