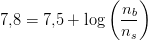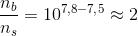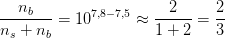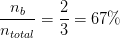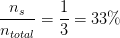Kemi
Molprocenter.
Hej - jeg har fået dette spørgsmål opgivet.
Hypochlorsyrling bruges til at desinficere svømmebassiner. Det reagerer som svag syre:
HClO(aq) =H+ (aq) + ClO-,
Ka= 3,0 *10-8
For at man skal kunne være i vandet uden at det svier for meget i øjnene, skal pH være 7,8.
Jeg er i tvivl om hvilken formel jeg skal anvende.. Umiddelbart hælder jeg til at anvende pufferligningen, men efter jeg har fundet pka værdien så ved jeg ikke hvad jeg skal gøre.
Hvad er de respektive molprocenter af HClO(aq) og ClO- ?
Svarmuligheder
-10% ClO- og 90% HClO
-33% ClO- og 67% HClO
-67% ClO- og 33% HClO
-50% ClO- og 50% HClO
-90% ClO- og 10% HClO
Skriv et svar til: Molprocenter.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.