Kemi
Puffer
02. december 2018 af
hashim23
-
Niveau: A-niveau
Hej
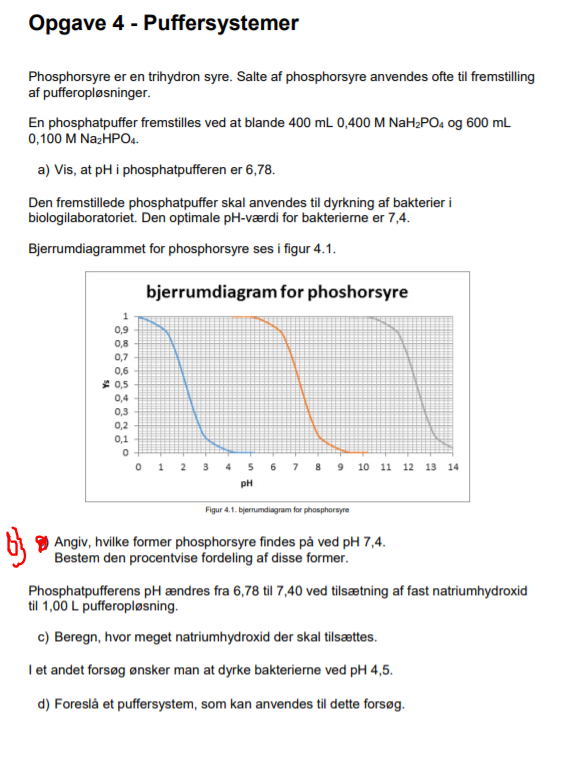
Har svært ved opg. c i den vedhæftet opgave.
Håber, at der er nogen der kan hjælpe mig med den.
Vedhæftet fil: puffer.PNG
Svar #3
04. december 2018 af hashim23
Ok, tak Mathon. Men hvorfor er det + x og - x. Kan du evt. forklare det, tak.
Skriv et svar til: Puffer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.