Ioner
Hvad er ioner?
En ion er et atom, der enten har optaget eller afgivet en eller flere elektroner. Elektroner har negative ladninger, og derfor vil et atom få en negativ ladning, når det optager en ekstra elektron, eksempelvis 

Sammensatte ioner
Sammensatte ioner er karakteriseret ved at være ioner, der består af mere end ét atom. Det kunne eksempelvis være ammonium-ionen 

Ionisering
En ionisering er den proces, der sker, når et atom eller molekyle går fra at være neutralt ladet til at have en ladning. Man kan med andre ord kalde det iondannelse. Det er altså en reaktion, hvor det stof, der skal ioniseres enten modtager eller afgiver en elektron. Indenfor ionisering taler man også om en ioniseringsenergi. Det er den energi, der skal tilføres et givet atom eller molekyle, for at fjerne en elektron. Ligeledes findes også en størrelse, der kaldes elektronaffiniteten. Den angiver den energi et atom eller molekyle ’modtager’, når det optager en elektron og dermed bliver negativt ladet.
Ionbalance
Ionbalance er et begreb, der anvendes særligt indenfor cellebiologien. For at opretholde liv i en celle er det nødvendigt, at koncentrationen af forskellige uorganiske forbindelser ligger indenfor et bestemt interval både inden i og uden for cellen. Denne koncentration kontrolleres af pumper i cellens membran, der sørger for enten at øge eller formindske koncentrationen af den givne ion i cellen. Forholdet mellem koncentrationen inde i cellen og uden for cellen samt koncentrationernes størrelse i det hele taget kaldes ionbalancen.
Ionvandring
Ionvandring det fænomen, hvor ioner rent fysisk bevæger sig væk fra deres startplacering. Ionvandring opnås, når et letopløseligt salt placeres på et vådt filterpapir, således at saltet dissocierer til de ioner, saltet består af. Ved at koble en jævnspændingskilde til filterpapiret genereres en transport af elektroner gennem filterpapiret fra minussiden til plussiden. Elektronerne tiltrækker modsatladede ioner, og derfor ses der også transport eller vandring af positivt ladede ioner mod minussiden. Som modreaktion hertil vil de negativt ladede ioner vandre mod plussiden. Fuldstændig forståelse af teorien bag fænomenet kræver dog en væsentlig længere og mere detaljeret forklaring.
Ionbytning
Ionbytning er, som ordet indikerer, en reaktion hvor to ioner ’bytter plads’. Ses der på de to salte blysulfat 



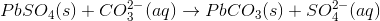
Det ses, at sulfat-ionen og carbonat-ionen bytter plads, og der er altså tale om en ionbytning.

