Salte
Hvad er et salt?
Et salt er en ionforbindelse mellem et metal og et ikke-metal. Det består altså en metallisk kation (en positivt ladet ion) og ikke-metallisk anion (en negativt ladet ion), der er bundet sammen af en ionbinding (link). Der er dog en undtagelse til reglen, idet ammoniumionen 


Saltes egenskaber
For alle salte gælder, at de er ladningsneutrale forbindelser. Det er altså ikke muligt at have et salt med en ladning, da forbindelsen i så fald ville være en ion. Endvidere danner et salt krystaller, når det tørres. Det betyder, at ionerne i saltet ordnes i et såkaldt iongitter (link). Formlen for saltet fortæller derfor kun noget om mængdeforholdet mellem de to ioner i dette tredimensionelle iongitter. Salte har typisk både et højt smeltepunkt og et højt kogepunkt.
Endeligt er et salt karakteriseret ved, at det danner ioner i en vandig opløsning, og på denne måde gør vandet i stand til at lede elektricitet. Som følge af denne egenskab er salte og ioner to tætknyttede kemiske grupper. Opløser man eksempelvis natriumchlorid (NaCl) i vand, fås følgende reaktionsskema. Man siger, at saltet dissocierer til ioner.
Opløseligheden af et salt
Et vigtigt koncept i forbindelse med dissociationen af salte i vand er opløseligheden af saltet. Saltes opløselighed i vand angiver, hvor stor en mængde af saltet der maksimalt kan opløses pr. volumen vand. Natriumchlorid er et eksempel på et letopløseligt salt, da det har en opløselighed på 357 gram pr. liter ved 25°C. Et tungtopløseligt salt er sølvbromid (AgBr), der har en opløselighed på bare 0,00014 gram pr. liter ved 25°C, og dermed i praksis er uopløseligt i vand. For opløseligheden gælder det, at der kan opløses mere stof, jo højere temperaturen af vandet er.
Fremstilling af salte
Et salt er produktet af en syre-base-reaktion, hvor saltet dannes af metallet (typisk fra basen) og syreresten. Eksempelvis kan kaliumnitrat 

Bemærk, at da reaktionen forløber i en vanding opløsning, vil saltet være opløst i vandet. Det vil derfor være nødvendigt at koge vandet væk for at få saltet på fast form.
Salte i organisk kemi
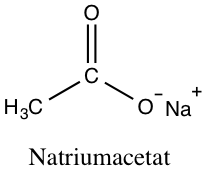
Der findes også salte indenfor organisk kemi, og disse salte fås ved at lade den ikke-metalliske anion være en organisk forbindelse. Et eksempel på et organisk salt er natriumacetat, der består af carboxylationen af eddikesyre 

Salte i hverdagen
Fra hverdagen kendes især natriumchlorid, der til dagligt også kaldes køkkensalt. Derudover er natron også et salt, nemlig natriumhydrogencarbonat 


Navngivning af salte
Salte navngives ved først at nævne navnet på det indgående metal (eller ammonium), og dernæst navnet på den anion, som metallet binder til.
LiCl Lithiumchlorid

Hvis saltet indeholder mere end én anion eller kation, nævnes dette ikke, da saltet altid indeholder lige mange positive og negative ladninger, således at det er ladningsneutralt. Ved eksempelvis magnesiumchlorid ved man, at magnesiumionen altid har en ladning på +2 og chlorid på -1. Saltet bliver derfor kun neutralt, hvis der er to chloridioner 




Hvis saltet indeholder et overgangsmetal, er der flere forskellige muligheder for metallets oxidationstal. Eksempelvis kan man ikke vide, om der i jernchlorid bruges 



Ved navngivning af salte er det altså kun nødvendigt at kende navnet på de to ioner i saltet, samt oxidationstallet for metallet, hvis saltet indeholder et overgangsmetal.




