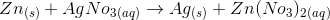Kemi
Redox
Er der nogle der kan hjælpe ?
Jeg ved at der er 2 af dem der ikke kan gå op pga spændingsrækken ....men ved ikke helt præcist hvordan man skal skrive reaktionsskemmaerne op .. Ville være glad for en forklaring/ fremgangsmåde.
Svar #1
29. april 2014 af Esterificering
Tag eksempelvis d)
Et stykke bly tilsættes i kobber(II)Chlorid-opløsningen.
Dette skrives således:
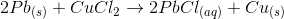
Start med at bruge spændingsrækken til at se hvilke metaller der er reaktionsvillige med hinanden.
Svar #2
29. april 2014 af Popmepi (Slettet)
Okay, så i teorien bytter du egentlig bare om på de to.
Kunne du prøve og gøre det med b)?
Og så forklare helt præcist hvad du gør step for step..? Ved godt at jeg lyder irreterende men vil gerne forstå det 100%
Tak (:
Svar #3
29. april 2014 af Popmepi (Slettet)
Forstår heller ikke helt hvordan du kommer frem til at der skal være 2 Pb
Svar #5
30. april 2014 af Esterificering
Først og fremmest betragter du hvilke metaller du har med at gøre.
Derefter slår du op i din spændingsrække, og finder det metal der skal blandes med opløsningen.
Hvis metallet som du skal nedsænke i væsken står til venstre for ''metalopløsningen'' er den reaktionsvillig, og der vil derfor ske en reaktion.
Spændingsrækken:
Li, Cs, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, H, Cu, Ag, Hg, Pt, Au
Herefter skal du kigge på ladningerne, du år oplyst at det er kobber(II)chlorid-opl.
dvs. at kobber-ionen har en ladning på +2 og derfor skal du bruge 2x Cl(minus) ioner for at neutralisere.
Giver dette mening indtil videre?
Skriv et svar til: Redox
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.