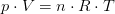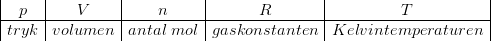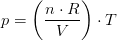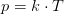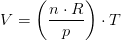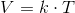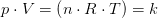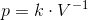Naturvidenskabeligt grundforløb (NVG)
Idelagasligningen
Jah, overskriften siger jo lidt sig selv. Men er der nogen herinde der kan forklare mig hvad idealgasligningen helt bestemt er? Synes ikke wikipedia og diverse sider hjælper mig helt nok til at forstå den, og jeg skal gerne kunne drage den ind i min eksamen på onsdag, hvis det er muligt.
Svar #2
19. oktober 2014 af forever21
Svar #5
19. oktober 2014 af GalVidenskabsmand (Slettet)
Idealgasligningen er en formel, som giver sammenhængen mellem tryk, rumfang og temperatur for en ideal gas.
En ideal gas er en hypotetisk gas, som består af molekyler, som:
1. ikke har noget rumfang
2. ikke påvirker hinanden med intermolekylære kræfter
3. som ikke taber kinetisk energi, når de støder sammen med hinanden eller med væggene i beholderen.
Når man bruger idealgasligningen på en virkelig gas, er der altså tale om en tilnærmelse. Som regel er det en ganske god tilnærmelse.
Skriv et svar til: Idelagasligningen
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.