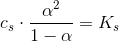Kemi
Dissociationsgrad / Protoloysegrad
Er der nogle der kan svare på - Hvad sker der med protolysegraden ved en fortynding?
Svar #4
11. december 2014 af Manpei (Slettet)
Hvad sker der så med protolyse graden når man sammenligner en svag og en middelstærk syre?
Svar #5
11. december 2014 af mathon
Sammenligningen skal så foregå ved samme koncentration.
Da en middelstærk syre har større Ks-værdi en den svage syre,
må
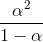 være større dvs
være større dvs 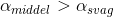 i samme vandige koncentration.
i samme vandige koncentration.
Svar #6
11. december 2014 af Heptan
Gælder Ostwalds fortyndingslov ved uendeligt fortyndede opløsninger? Dvs når cs → 0 ?
Svar #7
11. december 2014 af Manpei (Slettet)
@Mathon
Kunne det beskrives uden at anvende Ostwalds ?
Svar #9
11. december 2014 af Heptan
#8 Tak
#7 Du kan også bruge Le Chateliers princip til at forklare at reaktionen
HA + H2O → A- + H3O+
forskydes mod højre når der tilsættes vand på venstre side (når der fortyndes).
Da dissociationsgraden er givet ved
![\alpha = \frac{[A^-]}{c_s}](https://media.studieportalen.dk/images/equations/KCJcKyRFyd-tVtISTz217w==.gif)
... vil dissociationsgraden blive større, når [A-] bliver større som følge af ligevægtsforskydningen.
Svar #10
17. maj 2015 af overkontroversiel
Heptan, det passer vel ikke? Man kan ikke rigtigt bruge Le Chateliers princip.
Først og fremmest er koncentrationen af H2O så stor, da dets molbrøk sættes lig med 1, derfor er det ikke et korrekt argument.
Hvis du fortynder, vil du gør [HA] mindre, derfor vil reaktionen gå mod venstre for at genestablere ligevægt:
![\textup{K}_s=\frac{[\textup{A}^-][\textup{H}_3\textup{O}^+]}{[\textup{HA}]}](https://media.studieportalen.dk/images/equations/_qZYWWhNBowDahkKF3LBNA==.gif)
med andre falder [A-] og dermed protolysegraden. Men på den anden side falder også cs hvilket gør den større. Hvordan kan man rigtigt forklare det med Le Chateliers princip?
Svar #11
17. maj 2015 af Heptan
Det kommer virkelig an på hvilken opløsning der er tale om. Hvis man fx fortynder koncentreret svovlsyre vil aktiviteten for vand ikke være 1. Men lad os betragte en opløsning som allerede er fortyndet i en grad, så a(H2O) ≈ 1.
Man kan ikke se bort fra at [H2O] bliver meget større, og en god måde at benytte Le Chateliers princip vil være at indse at [HA], [A-] og [H3O+] alle bliver mindre ved fortynding, mens [H2O] ikke bliver mindre. Det vil forskyde ligevægten mod højre. Egentlig afhænger ligevægtens beliggenhed i opløsningen kun af pH og Ks (hvis vi ser bort fra aktiviteter). Vi indser at der for en uendeligt fortyndet opløsning gælder at pH = 7, dvs. ligevægten er forskudt mod højre, hvis syren er stærkere end vand.
Skriv et svar til: Dissociationsgrad / Protoloysegrad
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.